题目内容
11.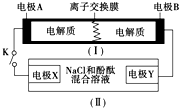 下图为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学反应方程式为:2K2S2+KI3 $?_{充电}^{放电}$K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红.则闭合K时,下列说法正确的是( )
下图为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学反应方程式为:2K2S2+KI3 $?_{充电}^{放电}$K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红.则闭合K时,下列说法正确的是( )| A. | K+从左到右通过离子交换膜 | |
| B. | 电极A上发生的反应为:3I--2e-═I3- | |
| C. | 电极X上发生的反应为:2Cl--2e-═Cl2↑ | |
| D. | 当有0.1 mol K+通过离子交换膜,X电极上产生1.12 L气体 |
分析 当闭合开关K时,X附近溶液先变红,说明X极生成OH-,应为电解池的阴极,发生反应为:2H2O+2e-=H2+2OH-,Y为电解池的阳极,发生:2Cl--2e-═Cl2↑,则A为原电池的负极,电极反应式为2K2S2-2e-═K2S4+2K+,B为原电池的正极,电极反应式为I3-+2e-═3I-,以此解答该题.
解答 解:当闭合开关K时,X附近溶液先变红,即X附近有氢氧根生成,所以在X极上得电子析出氢气,X极是阴极,Y极是阳极.与阴极连接的是原电池的负极,所以A极是负极,B极是正极.
A.原电池工作时,阳离子向正极移动,应从左到右通过离子交换膜,故A正确;
B.A为原电池的负极,电极反应式为2K2S2-2e-═K2S4+2K+,故B错误;
C.X为电解池的阴极,发生反应为:2H2O+2e-=H2↑+2OH-,故C错误;
D.当有0.1molK+转移时,根据2Cl--2e-═Cl2↑知产生0.05molCl2,因为压强、温度未知导致气体摩尔体积未知,所以无法计算氯气体积,故D错误;
故选A.
点评 本题考查化学电源新型电池,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,易错选项是D,注意气体摩尔体积适用范围及适用条件,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.原子结构模型的演变图如图,其中①为道尔顿实心球式原子模型,②为卢瑟福行星运转式原子模型,③为汤姆生葡萄干面包式原子模型,④为近代量子力学原子模型,⑤为玻尔轨道式原子模型.
这些模型的历史演变顺序是( )

这些模型的历史演变顺序是( )
| A. | ①②③④⑤ | B. | ①③②⑤④ | C. | ①⑤③②④ | D. | ①③⑤④② |
19.常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )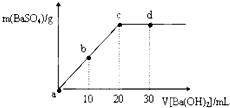

| A. | 硫酸溶液的体积为30 mL | |
| B. | b时刻溶液中SO42-的浓度约为0.125 mol•L-1 | |
| C. | d时刻溶液的pH约为13 | |
| D. | 溶液的导电能力:c<d=b<a |
6.长效阿司匹林的结构为: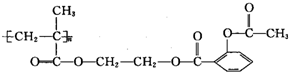 ,1mol该物质能与NaOH反应的物质的量是( )
,1mol该物质能与NaOH反应的物质的量是( )
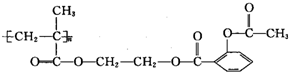 ,1mol该物质能与NaOH反应的物质的量是( )
,1mol该物质能与NaOH反应的物质的量是( )| A. | 3mol | B. | 4mol | C. | 3n mol | D. | 4n mol |
16.能够鉴定溴乙烷中存在溴元素的实验操作是( )
| A. | 加入NaOH的乙醇溶液,加热后加入AgNO3溶液 | |
| B. | 加入NaOH溶液加热,冷却后加入稀硝酸酸化,然后加入AgNO3溶液 | |
| C. | 在溴乙烷中直接加入AgNO3溶液 | |
| D. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 |
3.工业上冶炼金属钙可使用的方法是( )
| A. | 热分解法 | B. | 热还原法 | C. | 铝热剂法 | D. | 电解法 |
1.乙烯与高锰酸钾反应会放出CO2,下列操作中既可以用来鉴别乙烯和乙烷,又可以用来除去乙烷中混有的少量乙烯的操作方法是( )
| A. | 混合气通过盛有水的洗气瓶 | |
| B. | 通过装有过量溴水的洗气瓶 | |
| C. | 混合气通过装有酸性高锰酸钾溶液的洗气瓶 | |
| D. | 混合气与过量氢气混合 |
