题目内容
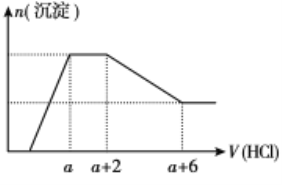
【题目】某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如图所示,下列说法正确的是
A. 原溶液中一定含有Na2SO4
B. 反应后最终溶液中的溶质只有AlCl3
C. 原溶液中含有CO32-与AlO2-的物质的量之比为1:1
D. 原溶液中一定含有的阴离子是OH-、SiO32-、AlO2-、CO32-
【答案】D
【解析】
依据图象分析可知,开始无沉淀生成说明加入的盐酸和溶液中的碱反应,说明溶液中一定含OH-离子,则与氢氧根离子不能共存的离子为Fe3+、Mg2+、Al3+;随后反应生成沉淀逐渐增大,说明是AlO2-、和氢离子反应生成氢氧化铝沉淀和硅酸沉淀,继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32-离子,反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定存在,但根据溶液的电中性可知,溶液中一定含有Na+离子。
A. 溶液中硫酸根离子不能确定,剩余原溶液不中一定含有Na2SO4,故A错误;
B. 反应最后形成的溶液中的溶质为NaCl和AlCl3,故B错误;
C. 依据图象可设:碳酸根离子反应的盐酸为2L,CO32+2H+=CO2↑+H2O;氢氧化铝溶解消耗的盐酸体积为4L,Al(OH)3+3H+=Al3++3H2O,原溶液中含有CO32与AlO2的物质的量之比为3:4,故C错误;
D. 依据分析判断,原溶液中一定含有的阴离子是OH-、SiO32-、AlO2-、CO32-,故D正确;
答案选D。

【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“>”、“<” 、“=”)。
②温度为500℃时,该反应10 min时达到平衡。用H2表示该反应的反应速率v(H2)=______________;该温度下,反应I的平衡常数K=______________L2/mol2
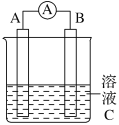
(4)由CO2制备甲醇还需要氢气。工业上用电解法制取Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。