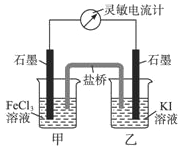
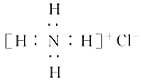题目内容
【题目】如图所示,是原电池的装置图。请回答:
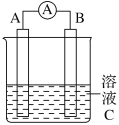
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为____________;
(2)若需将反应:Cu+2Fe3+===Cu2++2Fe2+设计成如上图所示的原电池装置,则A(负极)极材料为______,B(正极)极材料为________,溶液C为________。
(3)若C为CuCl2溶液,Zn是________极,Cu电极反应为_________________。反应过程溶液中c(Cu2+)________(填“变大”“变小”或“不变”)。
(4)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
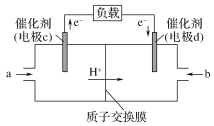
电池总反应为2CH3OH+3O2===2CO2+4H2O,则c电极是________(填“正极”或“负极”),c电极的反应方程式为________。若线路中转移2 mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为________L。
【答案】2H++2e-=H2↑ 铜 C FeCl3溶液 负 Cu2++2e-=Cu 变小 负极 H2O+CH3OH-6e-=CO2+6H+ 11.2
【解析】
利用原电池的工作原理,进行分析判断;
(1)C为稀硫酸,电流表指针发生偏转,B电极材料为Fe,且作负极,A电极为正极,总电极反应式为Fe+2H+=Fe2++H2↑,即A电极反应式为2H++2e-=H2↑;
答案为2H++2e-=H2↑;
(2)根据原电池工作原理,以及总电极反应式,负极材料是Cu,正极材料是石墨,溶液C为FeCl3;
答案为Cu;石墨;FeCl3溶液;
(3)Zn比Cu活泼,Zn为负极,锌电极反应式为Zn-2e-=Zn2+,Cu为正极,Cu电极反应式为Cu2++2e-=Cu,整个过程中Cu2+被消耗,即c(Cu2+)变小;
答案为负极;Cu2++2e-=Cu;变小;
(4)根据装置图,电子从电极c流向电极d,因此电极c为负极,燃料电池中通燃料一极为负极,即CH3OH在负极上失去电子,其电极反应式为H2O+CH3OH-6e-=CO2+6H+,消耗1molO2需要得到4mole-,因此电路中转移2mol电子,消耗氧气的物质的量为![]() =0.5mol,标准状况下,消耗氧气的体积为0.5mol×22.4L·mol-1=11.2L;
=0.5mol,标准状况下,消耗氧气的体积为0.5mol×22.4L·mol-1=11.2L;
答案为负极;H2O+CH3OH-6e-=CO2+6H+;11.2L。

【题目】如表实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向①4mL0.1mol·L-1KMnO4酸性溶液和②4mL0.2mol·L-1KMnO4酸性溶液中,分别加入4mL1mol·L-1H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 将苯、液溴和铁粉混合后,将产生的气体先通入CCl4,再通入水中,测所得水溶液的pH | pH<7 | 证明苯与液溴发生的是取代反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A. AB. BC. CD. D