题目内容
【题目】如图是甲醇——空气电池工作时的示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应。下列说法中正确的是
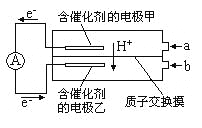
A. 正极反应式为:2H++2e—=H2↑
B. 乙电极为电池的负极,b处通入的物质是空气
C. 负极反应式为: CH3OH+H2O-6e—=CO2+6H+
D. 在电池反应中,每消耗l mol氧气,理论上能生成标准状况下CO2气体22.4L
【答案】C
【解析】
该燃料电池的本质为:2CH3OH+3O2=2CO2+4H2O,所以电池总反应式为:2CH3OH+3O2=2CO2+4H2O,CH3OH发生氧化反应,应在负极通入;O2发生还原反应,应在正极通入.电子从甲电极流出,经外电路流入乙电极,所以甲电极为负极,乙电极为正极;
A、正极电极反应式为:3O2+12H++12e-=6H2O,选项A错误;
B、甲电极为负极,选项B错误;
C、电池总反应式减去正极电极反应式即为负极电极反应式,即:2CH3OH+2H2O-12e-=2CO2+12H+,选项C正确;
D、由池总反应式为:2CH3OH+3O2=2CO2+4H2O,可知,每消耗lmol氧气,理论上能生成标准状况下CO2气体22.4L×![]() =14.9L,选项D错误。
=14.9L,选项D错误。
答案选C。

练习册系列答案
相关题目





