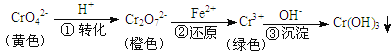题目内容
【题目】铝及其化合物在生产生活中具有重要的作用。
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)___。
(2)铝电池性能优越,在现代生产、生活中有广泛的应用。铝—空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
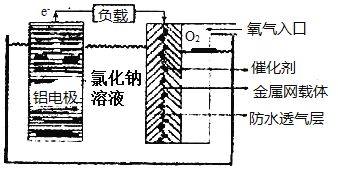
该电池的正极反应方程式为___,当铝电极质量减少9克,则另一极通入的氧气的体积在标准状况下为___。
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2。写出反应化学方程式为___。
(4)在元素周期表中,砷位于铝的下一周期,与氮元素同主族,写出AsH3分子的电子式为___,相同压强下,AsH3的沸点___NH3(填“大于”或“小于”)。
【答案】4Al+3O2=2Al2O3,表面能形成致密的氧化膜,能保护内层金属不被氧化 O2+4e-+2H2O=4OH- 5.6L AlCl3+3NaN3![]() 3NaCl+4N2↑+AlN
3NaCl+4N2↑+AlN ![]() 小于
小于
【解析】
(1) 铝属于活泼金属却能在空气中稳定存在,是因为铝在空气中能与氧气发生反应4Al+3O2=2Al2O3,生成的氧化铝是致密的氧化膜,能够有效的阻止内部的铝继续被氧化,故答案为:4Al+3O2=2Al2O3,表面能形成致密的氧化膜,能保护内层金属不被氧化;
(2)铝—空气电池,氯化钠溶液为中性电解质溶液,铝作负极发生反应:![]() ,空气中的氧气在正极发生反应:O2+4e-+2H2O=4OH-,当铝电极质量减少9克时,由电极反应可知铝失电子物质的量为
,空气中的氧气在正极发生反应:O2+4e-+2H2O=4OH-,当铝电极质量减少9克时,由电极反应可知铝失电子物质的量为![]() ,根据电子得失守恒可得消耗氧气物质的量为
,根据电子得失守恒可得消耗氧气物质的量为![]() ,标准状况下氧气的体积为
,标准状况下氧气的体积为![]() ,故答案为:O2+4e-+2H2O=4OH-;5.6L;
,故答案为:O2+4e-+2H2O=4OH-;5.6L;
(3) AlCl3与NaN3在高温下反应得氮化铝(AlN)和N2,根据原子守恒还有氯化钠生成,反应方程式为AlCl3+3NaN3![]() 3NaCl+4N2↑+AlN,故答案为:AlCl3+3NaN3
3NaCl+4N2↑+AlN,故答案为:AlCl3+3NaN3![]() 3NaCl+4N2↑+AlN;
3NaCl+4N2↑+AlN;
(4) AsH3分子的电子式为![]() ,相同压强下,NH3分子间存在氢键,氢键作用大于分子间作用力,导致NH3沸点大于AsH3的沸点,
,相同压强下,NH3分子间存在氢键,氢键作用大于分子间作用力,导致NH3沸点大于AsH3的沸点,
故答案为:![]() ;小于;
;小于;

【题目】下列离子方程式正确且与对应操作和目的相符的是
选项 | 目的 | 操作 | 离子方程式 |
A | 比较Fe2+和Br还原性强弱 | 向FeBr2溶液中加入少量氯水 | 2Br+Cl2=Br2+2Cl |
B | 比较C、Si非金属性强弱 | 向硅酸钠溶液中通入少量二氧化碳 | SiO32-+CO2+H2O=H2SiO3↓+ CO32- |
C | 除去CO2中的SO2 | 将气体通入盛有饱和碳酸氢钠溶液的洗气瓶 | CO32-+SO2=SO32-+CO2 |
D | 实验室制取氯气 | 向MnO2固体中加入浓盐酸并加热 |
|
A. AB. BC. CD. D