题目内容
8. 三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.(1)该反应的化学方程式为3F2+4NH3$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F,生成物NF3中氮原子的杂化方式为sp3杂化,NF3分子空间构型为三角锥形;
(2)N、F两种元素的氢化物稳定性比较,NH3<HF(选填“>”或“<”);
(3)N3-被称为类卤离子,写出2种与N3-互为等电子体的分子的化学式N2O;CO2;
(4)元素A基态原子的核外电子排布式为1s22s22p63s23p64s2,A跟氟可形成离子化合物,其晶胞结构如上图,该离子化合物的电子式为
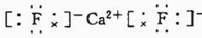 .
.
分析 (1)F2和过量的NH3反应生成NF3和NH4F,根据分子中δ键和孤电子对数判断杂化类型和分子的空间构型;
(2)元素的非金属性越强,对应的氢化物越稳定;
(3)N3-含有3个原子和22个电子,结合等电子体的定义分析;
(4)元素A基态原子的核外电子排布式为1s22s22p63s23p64s2,应为Ca元素,利用均摊法计算化学式,然后写出电子式.
解答 解:(1)F2和过量的NH3反应生成NF3和NH4F,反应的方程式为3F2+4NH3$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F,NF3中含有3个δ键,且孤电子对数为$\frac{5-3}{2}$=1,则应为sp3杂化,空间构型为三角锥形,
故答案为:3F2+4NH3$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F;sp3杂化;三角锥形;
(2)由于非金属性N<F,则HF更稳定,故答案为:<;
(3)N3-含有3个原子和22个电子,价电子总数为16,则对应的等电子体有CO2或CS2、N2O等,故答案为:N2O;CO2;
(4)元素A基态原子的核外电子排布式为1s22s22p63s23p64s2,应为Ca元素,由晶胞结构可知Ca2+离子位于晶胞的定点和面心,共含有8×$\frac{1}{8}$+6×$\frac{1}{2}$=4个,F-离子位于体心,共8个,则化学式为CaF2,其电子式为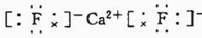 ,故答案为:
,故答案为: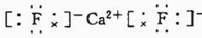 .
.
点评 本题考查较为综合,涉及杂化类型、空间构型、非金属性的比较、等电子体、电子式等,侧重于知识的掌握与迁移的考查,注意把握杂化类型的判断方法,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
16.化合物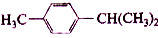 在核磁共振氢谱图中各信号的面积比为( )
在核磁共振氢谱图中各信号的面积比为( )
 在核磁共振氢谱图中各信号的面积比为( )
在核磁共振氢谱图中各信号的面积比为( )| A. | 3:2:2:1:6 | B. | 3:4:1:3:3 | C. | 9:4:1 | D. | 3:4:7 |
13.常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示:下列有关说法正确的是( )
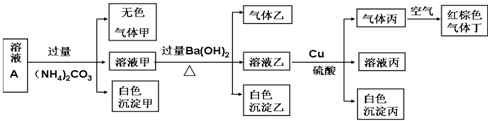

| A. | 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子 | |
| B. | 实验消耗Cu 14.4g,则生成气体丁的体积为3.36L | |
| C. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| D. | 一定没有Fe3+,但是无法确定是否含有I- |
17.用惰性电极插入KOH溶液中,在两极分别通入CH3OH和O2,有关此电池判断正确的是( )
| A. | 正极反应式:2CH3OH+2H2O-12e-═2CO2↑+12H+ | |
| B. | 放电一段时间后,负极的PH值升高 | |
| C. | 放电一段时间,阳离子向负极移动,阴离子向正极移动 | |
| D. | 该电池在工作时,每消耗32gCH3OH,外电路中通过6mole- |
18.某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl,下列说法正确的是( )
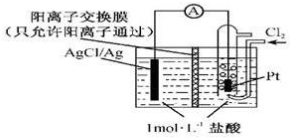

| A. | 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 正极反应为Ag-e-=Ag+ | |
| D. | 用KCl溶液代替盐酸,则电池总反应随之改变 |
 .
.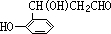 ;
;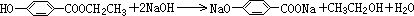 .
.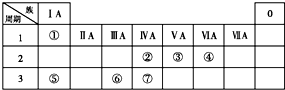 下表为元素周期表的一部分,请参照①~⑦相关元素在表中的位置,用化学用语回答下列问题:
下表为元素周期表的一部分,请参照①~⑦相关元素在表中的位置,用化学用语回答下列问题: