题目内容
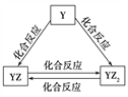
【题目】ClO2是一种消毒杀菌剂,实验室可通过下列反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是![]()
![]()
A. KClO3在反应中得到电子B. ClO2是氧化产物
C. H2C2O4被还原D. 1molKClO3发生反应,转移的电子数为2NA
【答案】A
【解析】
试题解析: 2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O;该反应中,KClO3氯元素由+5价变为+4价;得电子被还原,对应还原产物;H2C2O4中碳元素由+3价变为+4价;失电子被氧化,对应氧化产物;该反应共转移电子数为2KClO3→2e-; 1molKClO3发生反应,转移的电子数为NA;答案D错误;正确答案为A正确;
考点:氧化还原反应相关知识的考察。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。