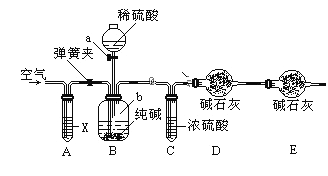
题目内容
【题目】现有NH3、CO、Na、Na2O2、Fe、NO、NO2、Cl2、SO2等中学化学教材中出现过的物质,根据它们的组成及性质进行如下分类:
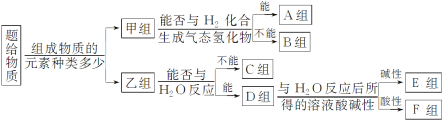
请回答下列问题:
(1)淡黄色固体最终位于________组。(填“A~F”)
(2)C组有一种气体常用作工业上冶炼铁的还原剂,写出高温下它还原Fe2O3的化学方程式:_____________。
(3)F组某种物质能与水发生氧化还原反应,该反应中被氧化与被还原的元素的质量比为_____________。
(4)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有8×6.02×1023个电子转移,则有________g该物质参与反应。
【答案】E3CO+Fe2O3![]() 2Fe+3CO22:1168
2Fe+3CO22:1168
【解析】
NH3、CO、Na、Na2O2、Fe、NO、NO2,SO2、Cl2 等,按照组成元素的多少分为单质和化合物,属于单质的是Na、Fe、Cl2,属于化合物的是NH3、CO、Na2O2、NO、NO2、SO2;单质中能与氢气反应的是Cl2;化合物中能与水反应的是NH3、Na2O2、NO2、SO2,反应显碱性的是NH3、Na2O2。
(1)淡黄色固体为Na2O2,可与水反应生成NaOH和氧气,最终位于E组,故答案为:E;
(2)C组有一种气体常用作工业上冶炼铁的还原剂是CO,CO与Fe2O3在高温条件下生成Fe和二氧化碳,反应方程式为:Fe2O3+3CO![]() 2Fe+3CO2;故答案为:Fe2O3+3CO
2Fe+3CO2;故答案为:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(3)F组的某种物质能与水发生氧化还原反应,该物质为NO2,NO2与水反应产生3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,由产物中氮元素的化合价,可知起氧化剂与还原剂的NO2物质的量之比为1:2,所以被氧化的NO2与被还原的NO2的物质的量之比为2:1;故答案为:2:1;
(4)B组中与水在高温条件下反应的物质为Fe,反应的方程式为4H2O(g)+3Fe![]() Fe3O4+4H2,若该反应过程中有8×6.02×1023个电子转移,即转移8mol电子,则消耗3molFe,即3mol×56g/mol=168g,故答案为:168。
Fe3O4+4H2,若该反应过程中有8×6.02×1023个电子转移,即转移8mol电子,则消耗3molFe,即3mol×56g/mol=168g,故答案为:168。