题目内容
4.下列各元素,按原子半径依次增大,元素最高正价逐渐降低的顺序排列的是( )| A. | F、Cl、Br | B. | Al、Mg、Na | C. | N、S、Cl | D. | F、O、N |
分析 电子层越多,原子半径越大,同周期原子序数大的原子半径小;同周期从左向右元素最高正价逐渐增大,O、F无正价,以此来解答.
解答 解:A.F、Cl、Br的原子半径逐渐增大,F没有正价,Cl、Br的最高正价相同,故A不选;
B.Al、Mg、Na位于同周期,原子半径逐渐增大,最高正价逐渐降低,故B选;
C.N、S、Cl的原子半径为S>Cl>N,N、S、Cl的最高正价逐渐增大,故C不选;
D.F、O、N的原子半径逐渐增大,O、F没有正价,故D不选;
故选B.
点评 本题考查元素周期律和元素周期表的应用,为高频考点,把握同周期、同主族元素的性质及比较为解答的关键,注意规律性知识的应用,侧重原子半径及化合价的考查,题目难度不大.

练习册系列答案
相关题目
14.青少年在生长发育过程中对蛋白质的需求量很大,下列食品中富含蛋白质的是( )
| A. | 水果 | B. | 馒头 | C. | 牛奶 | D. | 花生油 |
12.根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是( )
| A. | 两者都为s-sσ键 | B. | 两者都为p-pσ键 | ||
| C. | 前者为p-pσ键,后者为s-pσ键 | D. | 前者为s-sσ键,后者为s-pσ键 |
9.如图图示与对应的叙述相符的是( )


| A. | 由图甲表示的反应速率随温度变化的关系可知该反应的△H>0 | |
| B. | 图乙表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)═N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| C. | 图丙表示该反应为放热反应,且催化剂能改变反应的焓变 | |
| D. | 绝热恒容密闭容器中发生反应:SO2(g)+NO2(g)?SO3(g)+NO(g),其正反应速率随时间变化如图丁所示,则c点一定是平衡点 |
16.下列各项中表达正确的是( )
| A. | 过氧化钠的分子式:Na2O2 | B. | F-的结构示意图: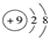 | ||
| C. | NaCl的电子式: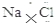 | D. | N2的结构式::N≡N: |
15.下列实验能达到预期目的是( )
| A. |  用于判断SO2能否与钡盐反应 | B. |  用于判断硼酸、碳酸的酸性强弱 | ||
| C. | 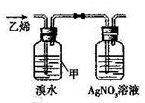 用于判断甲中发生的是加成反应 | D. | 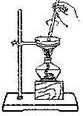 用于AlCl3的蒸发结晶 |
