题目内容
14.金属铝、铁、铜与人类生产、生活息息相关.(1)基态铝原子核处在能量最高的能级上的电子共有1种不同的运动状态,工业电解熔融氧化铝时要添加助熔剂Na3[AlF6].由氟化钠和硫酸铝可以抽取Na3[AlF6],反应的化学方程式为12NaF+Al2(SO4)3$\frac{\underline{\;高温\;}}{\;}$2Na3AlF6+3Na2SO4.
(2)聚合硫酸铁(简称PFS)的化学式为[Fe(OH)n(SO4)(3-n)]m,是常用的水处理剂,与PFS中铁元素价态相同的铁离子的电子排布式为1s22s22p63s23p63d5或[Ar]3d5,SO42-的空间构型是空间正四面体.
(3)下列关于[Cu(NH3)4]SO4、K4[Fe(CN)6]、Na3[AlF6]的说法中正确的有ad(填字母).
a.三种物质中含有的化学键类型均有离子键和配位键
b.三种物质的组成元素中电负性最大与最小的两种非金属元素形成的晶体属于离子晶体
c.三种物质的组成元素中第一电离能最大的是氮元素
d.K4[Fe(CN)6]与Na3[AlF6]的中心离子具有相同的配位数
(4)某种含Cu2+的化合物可催化氧化丙烯醇(HOCH2CH=CH2)制备丙醛(CH3CH2CHO),在丙烯醇中共有9个σ键,其中碳原子的杂化方式是sp2、sp3.
(5)用晶体的X射线衍射法可以测得阿伏加德罗常数的值.对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361pm.又知铜的密度为9.0g/cm3,则铜原子的直径为$\frac{361}{\sqrt{2}}$pm,阿伏加德罗常数的值为6.05×1023.
分析 (1)铝是13号元素,根据核外电子排布规律分析,铝基态原子核外能量最高的能级为3p,排布了1个电子,有1种不同的运动状态;首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可;
(2)铁有两种阳离子,亚铁离子在空气中不能稳定存在,而铁离子在空气中科院稳定存在,可以推断化合价为+3价,据此书写铁离子的电子排布式;根据价层电子对互斥模型判断SO42-的空间结构;
(3)a.均含金属离子与配位离子之间的离子键,配位离子中含配位键;
b.电负性最大的为F,电负性最小的为氢;
c.非金属性最强的为F,其电负性最大,第一电离能最大;
d.由化学式可知,配位数均为6;
(4)有机物中C=C键中含有1个σ键和1个π键;根据杂化理论在丙烯醇中构成C=C的两个碳原子是sp2杂化,另一个C为sp3杂化;
(5)根据铜晶胞为面心立方最密堆积,由边长可计算出晶胞的体积,根据m=ρ×V计算质量,由晶胞可知Cu原子在顶点和面心,以此计算.
解答 解:(1)铝是13号元素,其基态原子的电子排布式为:1s22s22p63s23p1,原子核外能量最高的能级为3p,排布了1个电子,有1种不同的运动状态,硫酸铝和氟化钠(NaF)在熔融条件下反应生成冰晶石(Na3AlF6),同时得到硫酸钠,化学方程式为:12NaF+Al2(SO4)3$\frac{\underline{\;高温\;}}{\;}$2Na3AlF6+3Na2SO4,
故答案为:1;12NaF+Al2(SO4)3$\frac{\underline{\;高温\;}}{\;}$2Na3AlF6+3Na2SO4;
(2)絮状物在空气之中能稳定存在说明为铁离子,因为亚铁离子在空气中不稳定,故铁的化合价为+3价,铁离子的电子排布式为1s22s22p63s23p63d5,SO42-中S原子的价层电子对数为$\frac{6+2}{2}$=4,所以S原子的杂化方式为sp3杂化,SO42-空间构型为正四面体,
故答案为:1s22s22p63s23p63d5;空间正四面体;
(3)a.[Cu(NH3)4]SO4、K4[Fe(CN)6]、Na3[AlF6]晶体都为配位化合物,晶体中存在化学键类型都为配位键和离子键,故a正确;
b.电负性最大的为F,电负性最小的为氢,形成的晶体属于分子晶体,故b错误;
c.三种物质的组成元素中第一电离能最大的是氟元素,故c错误;
d.K4[Fe(CN)6]与Na3[AlF6]的中心离子具有相同的配位数,均为6,故d正确;
故答案为:ad;
(4)C=C键中含有1个σ键和1个π键,则丙烯醇(CH2=CHCH2OH)中共有9个σ键和1个π键,丙烯醇(CH2=CHCH2OH)中构成C=C的两个碳原子是sp2杂化,另一个C为sp3杂化,
故答案为:9; sp2、sp3;
(5)根据铜晶胞为面心立方最密堆积,由边长可计算出晶胞的体积V=(361 pm)3≈4.70×10-23 cm3,根据m=ρ×V=9.00 g•cm-3×4.70×10-23cm3=4.23×10-22g;
由于一个铜晶胞中含有的铜原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4(个),每个铜原子的体积约为=4.70×10-23 cm3÷4=1.18×10-23 cm3,则$\frac{1}{6}$×π×d3=1.18×10-23 cm3,解得铜原子的直径d=$\frac{361}{\sqrt{2}}$pm≈255pm;NA=$\frac{63.6g/mol}{\frac{1}{4}×4.23×1{0}^{-22}g}$≈6.05×1023mol-1,
故答案为:$\frac{361}{\sqrt{2}}$或255;6.05×1023.
点评 本题考查晶胞计算及物质结构,为高频考点,侧重选修三物质结构与性质的考查,涉及电子排布、杂化及晶胞计算等,注重高频考点的考查,综合性较强,(5)为解答难点,题目难度中等.

| A. | 三种元素可组成CAB2和CAB3型化合物 | |
| B. | 离子半径:A3->B2->C+ | |
| C. | 氢化物稳定性:AH3>H2B | |
| D. | B的某种单质可用于杀菌消毒 |
| A. | F、Cl、Br | B. | Al、Mg、Na | C. | N、S、Cl | D. | F、O、N |
| A. | 1moL苯乙烯(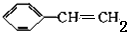 )中含有的碳酸双键数为4NA )中含有的碳酸双键数为4NA | |
| B. | 加热条件下,4.6g金属Na与足量O2反应的产物中阴离子的数目为0.1NA | |
| C. | 室温条件下,pH=9,体积为1L的CH4COONa溶液中,发生电离的水分子数为1.0×10-4NA | |
| D. | 高温条件下,16.6g铁粉与足量水蒸气反应后,转移电子数为0.9NA |
| A. | 葡萄糖注射液能产生丁达尔效应 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 二氧化硫的大量排放是造成光化学烟雾的主要原因 | |
| D. | 汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 |
| 选项 | 甲 | 乙 | 丙 | 实验结论 | 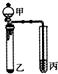 |
| A | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:碳>硅 | |
| B | 双氧水 | MnO2 | Na2S | 氧化性:H2O2>O2>S | |
| C | 浓硫酸 | Na2SO3 | 酸性KMnO4溶液 | SO2具有漂白性 | |
| D | 浓氨水 | 氢氧化钠固体 | 酚酞 | 碱性:NaOH>NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
| A | B | C | D | |
| 装置 |  |  H2(g)+I2(g)?2HI(g) | 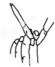 |  |
| 目的 | 检验碳与浓硫酸反应的氧化产物 | 验证压强对化学平衡的影响 | 检查碱式滴定管是否漏液 | FeSO4溶液的蒸发结晶 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆,原理相似 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 |