题目内容
【题目】(1)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
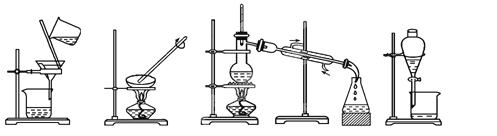
① ② ③ ④
从海水中提取水:____________;从KCl溶液中获取KCl晶体:____________;
分离CaCO3和水:____________;分离植物油和水:____________。
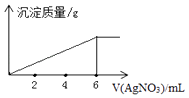
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
实验① | 实验② | 实验③ | |
取甲瓶溶液的量 | 400 mL | 120 mL | 120 mL |
取乙瓶溶液的量 | 120 mL | 440 mL | 400 mL |
生成沉淀的量 | 1.56 g | 1.56 g | 3.12 g |
①甲瓶溶液为________溶液。
②乙瓶溶液为________溶液,其物质的量浓度为________mol·L-1。
【答案】 ③ ② ① ④ AlCl3 NaOH 0.5
【解析】(1)水易挥发,海水中提取水可用蒸馏的方法,答案选③;从 KCl溶液中获取KCl晶体,可用蒸发的方法,答案选②;CaCO3不溶于水,分离CaCO3和水,可用过滤的方法,答案选①;植物油和水互不相溶,分离植物油和水,可用分液的方法,答案选④;
(2)氯化铝滴入NaOH溶液中,开始氢氧化钠过量,发生反应AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,然后发生反应:3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl;氢氧化钠溶液滴入AlCl3溶液中,开始发生反应:AlCl3+3NaOH═Al(OH)3↓+3NaCl,然后发生反应:Al(OH)3+NaOH═NaAlO2+2H2O,由②和③可知,一定量的甲与乙反应时,乙的量越多,生成的沉淀越少,则乙为NaOH溶液,即甲为AlCl3溶液,乙为NaOH溶液,由实验①②可知,实验①中NaOH不足,AlCl3有剩余,根据AlCl3+3NaOH═Al(OH)3↓+3NaCl,1.56g沉淀的物质的量为![]() =0.02mol,则NaOH的物质的量为0.02mol×3=0.06mol,故NaOH溶液的物质的量浓度为0.06mol/0.12L=0.5mol/L。
=0.02mol,则NaOH的物质的量为0.02mol×3=0.06mol,故NaOH溶液的物质的量浓度为0.06mol/0.12L=0.5mol/L。
【题型】综合题
【结束】
18
【题目】(1)向AlCl3溶液中,滴加少量NaOH溶液,现象是________________________
继续滴加NaOH溶液至过量,现象是_______________。
(2)钠与水反应的离子方程式为_______________,该反应中氧化剂是_______________,产生1mol H2时,转移电子的物质的量为_______________mol。
(3)经常有人因误食亚硝酸钠(NaNO2)而中毒。原因是NaNO2像食盐一样既有咸味,又有很强毒性。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O
①该反应的氧化剂是_______,被氧化的是_________元素。
②若此反应中电子转移数目为0.5mol,则被氧化的还原剂的物质的量为___________。
【答案】 产生白色沉淀 白色沉淀消失 2Na + 2H2O ![]() 2Na++ 2OH- + H2↑ 水或H2O 2 NaNO2 碘(或I) 0.5 mol
2Na++ 2OH- + H2↑ 水或H2O 2 NaNO2 碘(或I) 0.5 mol
【解析】(1)向AlCl3溶液中,滴加少量NaOH溶液,发生反应AlCl3+3NaOH═Al(OH)3↓+3NaCl,现象是产生白色沉淀;继续滴加NaOH溶液至过量,发生反应Al(OH)3+NaOH═NaAlO2+2H2O,现象是白色沉淀消失;(2)钠与水反应生成氢氧化钠与氢气,反应离子方程式为:2Na + 2H2O ![]() 2Na++ 2OH- + H2↑,反应中水中H元素化合价由+1价降低为0价,水是氧化剂,生成1molH2时转移电子的物质的量为1mol×2=2mol;(3)①反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O中,元素化合价的变化分别如下:氮元素:NaNO2 →NO,由+3价→+2价,得电子,所以NaNO2是氧化剂;碘元素,HI→I2,由-1价→0价,失电子,被氧化的是碘元素;②根据反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O可知,若此反应中电子转移数目为0.5mol,则被氧化的还原剂的物质的量为0.5 mol。
2Na++ 2OH- + H2↑,反应中水中H元素化合价由+1价降低为0价,水是氧化剂,生成1molH2时转移电子的物质的量为1mol×2=2mol;(3)①反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O中,元素化合价的变化分别如下:氮元素:NaNO2 →NO,由+3价→+2价,得电子,所以NaNO2是氧化剂;碘元素,HI→I2,由-1价→0价,失电子,被氧化的是碘元素;②根据反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O可知,若此反应中电子转移数目为0.5mol,则被氧化的还原剂的物质的量为0.5 mol。

【题目】以工业废铁屑为原料生产氧化铁红颜料并进行适当的综合利用,其主要流程如图: 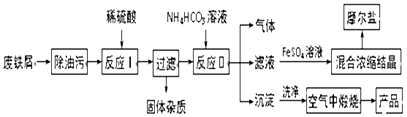
已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液.
(1)写出在空气中煅烧沉淀的化学反应方程式: .
(2)本流程中产生的CO2和H2 , 在催化剂作用下按体积比1:1合成一种重要的有机化工原料R,该合成符合绿色化学要求.已知液体R的燃烧热为254.6 kJ/mol,则R完全燃烧的热化学方程式为
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4FeSO46H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4FeSO46H2O粗产品,下列方法中最合适的是
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c molL﹣1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如表:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
KMnO4溶液应盛装在滴定管中,滴定过程中发生反应的离子方程式为滴定终点的现象是通过实验数据计算的该产品纯度为(用字母ac表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.