题目内容
【题目】在5mL0.02mol/L某金属氯化物(MCln)溶液中,滴加0.05mol/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为( ) 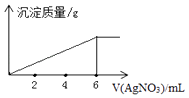
A.+1
B.+2
C.+3
D.+4
【答案】C
【解析】解:根据化学式知,某金属氯化物(MCln)溶液中n(Cl﹣)=0.02mol/L×0.005L×n=10﹣4 mol,当二者完全完全反应时消耗的硝酸银溶液体积为6mL,此时n(Cl﹣)=n(Ag+)=n(AgNO3)=0.05mol/L×0.006L=0.0003mol,则n=3,则该化合物化学式为MCl3 , 则M化合价为+3价,故选C.
根据化学式知,某金属氯化物(MCln)溶液中n(Cl﹣)=0.02mol/L×0.005L×n=10﹣4 mol,当二者完全完全反应时消耗的硝酸银溶液体积为6mL,此时n(Cl﹣)=n(Ag+)=n(AgNO3)=0.05mol/L×0.006L=0.0003mol,则n=3,据此计算金属元素化合价.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
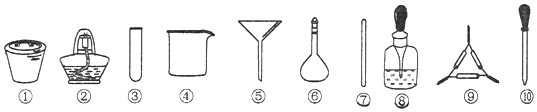
单元加期末复习先锋大考卷系列答案【题目】(1)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
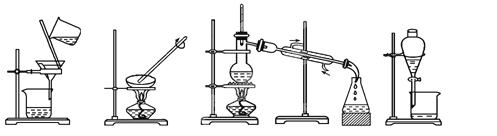
① ② ③ ④
从海水中提取水:____________;从KCl溶液中获取KCl晶体:____________;
分离CaCO3和水:____________;分离植物油和水:____________。
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
实验① | 实验② | 实验③ | |
取甲瓶溶液的量 | 400 mL | 120 mL | 120 mL |
取乙瓶溶液的量 | 120 mL | 440 mL | 400 mL |
生成沉淀的量 | 1.56 g | 1.56 g | 3.12 g |
①甲瓶溶液为________溶液。
②乙瓶溶液为________溶液,其物质的量浓度为________mol·L-1。
【答案】 ③ ② ① ④ AlCl3 NaOH 0.5
【解析】(1)水易挥发,海水中提取水可用蒸馏的方法,答案选③;从 KCl溶液中获取KCl晶体,可用蒸发的方法,答案选②;CaCO3不溶于水,分离CaCO3和水,可用过滤的方法,答案选①;植物油和水互不相溶,分离植物油和水,可用分液的方法,答案选④;
(2)氯化铝滴入NaOH溶液中,开始氢氧化钠过量,发生反应AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,然后发生反应:3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl;氢氧化钠溶液滴入AlCl3溶液中,开始发生反应:AlCl3+3NaOH═Al(OH)3↓+3NaCl,然后发生反应:Al(OH)3+NaOH═NaAlO2+2H2O,由②和③可知,一定量的甲与乙反应时,乙的量越多,生成的沉淀越少,则乙为NaOH溶液,即甲为AlCl3溶液,乙为NaOH溶液,由实验①②可知,实验①中NaOH不足,AlCl3有剩余,根据AlCl3+3NaOH═Al(OH)3↓+3NaCl,1.56g沉淀的物质的量为![]() =0.02mol,则NaOH的物质的量为0.02mol×3=0.06mol,故NaOH溶液的物质的量浓度为0.06mol/0.12L=0.5mol/L。
=0.02mol,则NaOH的物质的量为0.02mol×3=0.06mol,故NaOH溶液的物质的量浓度为0.06mol/0.12L=0.5mol/L。
【题型】综合题
【结束】
18
【题目】(1)向AlCl3溶液中,滴加少量NaOH溶液,现象是________________________
继续滴加NaOH溶液至过量,现象是_______________。
(2)钠与水反应的离子方程式为_______________,该反应中氧化剂是_______________,产生1mol H2时,转移电子的物质的量为_______________mol。
(3)经常有人因误食亚硝酸钠(NaNO2)而中毒。原因是NaNO2像食盐一样既有咸味,又有很强毒性。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O
①该反应的氧化剂是_______,被氧化的是_________元素。
②若此反应中电子转移数目为0.5mol,则被氧化的还原剂的物质的量为___________。
【题目】下列物质的分离提纯中除杂剂及相应的化学方程式分别为
混合物成分 | 除杂试剂 | 化学方程式 |
(i)铜粉中混有铁粉 | ||
(ii)铁粉中混有铝粉 | ||
(iii)Al2O3中混有Al(OH)3 | ||
(iv)FeCl3溶液中混有FeCl2 |