题目内容
【题目】Ⅰ.海水晒盐后所得的苦卤中含有较高浓度的MgCl2、KCl以及金属溴化物。以下是苦卤化学分离的过程。
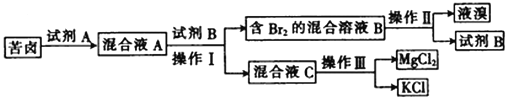
回答下列问题:
(1)若试剂A是一种有色气体单质,则A是_______(填化学式);
(2)“操作II”是_______,“操作III”是_______。(填字母)
a.蒸发 b.蒸馏 c.分液 d.重结晶
(3)试剂B可能是下列物质中的________。(填字母)
a.饱和NaCl溶液 b.CCl4 c.NaOH d.乙醇
Ⅱ.一种工业制备SrCl2·6H2O的生产流程如下图所示:
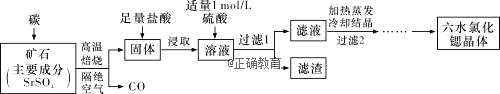
已知:①M(SrCl2·6H2O)=267g·mol-1;②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10;③经盐酸浸取后,溶液中有Sr2+和Cl-及少量Ba2+。
(1)加入硫酸溶液的目的是______________;为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol·L1 (注:此时滤液中Ba2+浓度为1×105 mol·L1)。
(2)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×102 mol的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol·L1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为_______(保留4位有效数字)。
【答案】Cl2 bdb除去Ba2+杂质0.03加入最后一滴标准液,溶液由无色变为红色,且30 s不褪色93.45%
【解析】
Ⅰ、海水晒盐后所得的苦卤中含有较高浓度的MgCl2、KCl以及金属溴化物,加入试剂A为氧化剂,发生反应生成溴单质,加入萃取剂四氯化碳萃取分液得到含溴单质的混合溶液B和混合溶液C,混合溶液B通过蒸馏得到液溴和试剂B为四氯化碳,混合溶液C通过结晶法分离氯化镁和氯化钾。
(1)若试剂A是一种有色气体单质,则A是Cl2 ,氯气氧化溴离子生成溴单质,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,故答案为:Cl2;
(2)操作II”是从萃取剂中分离出溴单质,利用物质沸点不同,控制温度通过蒸馏方法分离得到溴单质,操作III是浓缩结晶的方法分离混合物,可以利用重结晶方法分离氯化镁和氯化钠,故答案为:b;d;
(3)试剂B是萃取剂,萃取剂与水不互溶,且溴不易溶于水,易溶于萃取剂,且不发生反应,acd水溶液中不能分层不能做萃取剂,四氯化碳不溶于水,溴单质再四氯化碳中溶解度大于水中可以做萃取剂,故选b,故答案为:b;
Ⅱ、(1)经盐酸浸取后的溶液中含有少量Ba2+杂质,加入硫酸的目的是除去溶液中Ba2+杂质,由于在Ba2+浓度为1×10-5 mol/L,BaSO4的溶度积常数为1.1×10-10,所以c(SO42-)=![]() mol/L=1.1×10-5mol/L,而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=
mol/L=1.1×10-5mol/L,而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=![]() mol/L=0.03mol/L,故答案为:除去溶液中Ba2+杂质;0.03;
mol/L=0.03mol/L,故答案为:除去溶液中Ba2+杂质;0.03;
(2)①Ag+ 完全以AgSCN白色沉淀的形式析出后,再滴加KSCN溶液,就会与Fe3+产生络合物是溶液变为红色,因此滴定达到终点时溶液由无色变为血红色,且30 s不褪色,故答案为:溶液由无色变为血红色,且30 s不褪色;
②n(NH4SCN)=0.2000mol/L×0.02L=4.0×10-3mol,Ag+以AgSCN白色沉淀的形式析出,所以溶液中剩余的Ag+的物质的量为:n(Ag+)=4.0×10-3mol,则与Cl-反应的Ag+的物质的量为:n(Ag+)=1.100×10-2 mol-4.0×10-3mol=7.0×10-3mol,1.000g产品中SrCl26H2O的物质的量为:n(SrCl26H2O)=![]() ×n(Ag+)=3.5×10-3mol,1.000g产品中SrCl26H2O的质量为:m(SrCl26H2O)=3.5×10-3mol×267 g/mol=0.9345g,所以产品纯度为:
×n(Ag+)=3.5×10-3mol,1.000g产品中SrCl26H2O的质量为:m(SrCl26H2O)=3.5×10-3mol×267 g/mol=0.9345g,所以产品纯度为:![]() ×100%=93.45%,故答案为:93.45%。
×100%=93.45%,故答案为:93.45%。