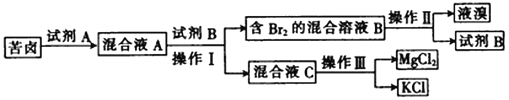
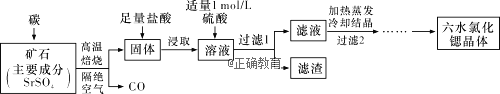
题目内容
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)

回答下列问题:
(1)按如图所示的装置连接完仪器,在加药品之前应该做的操作是______________
(2)装置A中液体试剂选用_____________________________,
(3)装置B的作用是___________________________________,装置C的作用是____________________________________,装置E中碱石灰的作用是____________________________________________,
(4)装置D中发生反应的化学方程式是______________________________________
(5)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
【答案】检查装置的气密性 6mol/LHCl 除去CO2中的HCl 干燥CO2 除去O2中的CO2 2Na2O2 + 2CO2 = 2Na2CO3 + O2 78%
【解析】
(1)按如图所示的装置连接完仪器,在加药品之前应该做的操作是检查装置的气密性。答案:检查装置的气密性。
(2)实验室中用CaCO3与盐酸反应制取CO2而不用H2SO4,原因是H2SO4,与CaCO3反应生成的CaSO4溶解度较小,会覆盖在CaCO3固体表面,阻止反应的继续进行,所以装置A中液体试剂选用6mol/LHCl。 答案:6mol/LHCl。
(3)装置B、C为净化CO2的装置,装置E是除去氧气中的二氧化碳和水。因为选择的是6mol/LHCl做反应物,HCl具有挥发性,所以CO2中混有HCl和水蒸气,因此装置B的试剂是为了除去HCl,装置C是除去水蒸气。装置E中碱石灰的作用是除去O2中的CO2。答案:除去CO2中的HCl;干燥CO2 ;除去O2中的CO2。
(4)装置D中装的是Na2O2,所发生反应的化学方程式是2Na2O2+ 2CO2 = 2Na2CO3 + O2,答案:Na2O2+2CO2=2Na2CO3+O2。
(5)根据反应2Na2O2+ 2CO2 = 2Na2CO3 + O2中Na2O2与O2的关系,可由生成O2的量计算.由标准状况气体体积为224 mL知,n(O2)=0.01mol设样品中含Na2O2的质量为xg:
2Na2O2+ 2CO2 = 2Na2CO3 + O2
78![]() 2 1
2 1
x 0.01mol,解得x=1.56g
Na2O2试样的纯度为1.56g /2.0 g![]() 100
100![]() =78%,答案:78%。
=78%,答案:78%。

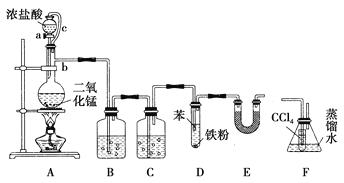
【题目】(题文)某实验小组利用如图装置合成氯苯(支撑用的铁架台部分省略)并通过一定操作提纯氯苯。
反应物和产物的相关数据列表如下:
密度/g·cm-3 | 沸点/℃ | 水中溶解性 | |
苯 | 0.879 | 80.1 | 微溶 |
氯苯 | 1.11 | 131.7 | 不溶 |
请按要求回答下列问题。
(1)仪器b的名称是________。
(2)A装置中制备Cl2的离子方程式为______________________________。
(3)氯气在通入D之前需净化干燥,则装置C中所加试剂的名称为________。
(4)D中通入氯气后,先看到苯呈黄色,片刻试管液面上方有白雾产生,装置E的作用是________。
(5)为证明氯气和苯发生的是取代反应而不是加成反应,该小组用装置F说明,则装置F置于______之间(填字母),F中小试管内CCl4的作用是________,还需使用的试剂是________。
(6)D中混合物经过滤除铁、加水及NaOH溶液洗涤、无水氯化钙干燥等分离操作后得粗氯苯,粗氯苯中还含有的主要杂质为________,要进一步提纯,下列操作中必需的是________(填入正确选项前的字母)。
A.重结晶 B.分液 C.萃取 D.蒸馏
(7)已知D中加入5 mL苯,经过提纯后收集到氯苯3.0g,则氯苯的产率为________%(保留三位有效数字)。
【题目】温度为T时,向4L恒容密闭容器中充入2 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是 ( )
A. 反应在前50 s的平均速率为v(PCl3)=0.006 4 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入4 mol PCl3、4 mol Cl2,达到平衡时,则此反应的化学平衡常数为0.025
D. 相同温度下,起始时向容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)<v(逆)