题目内容
向172g Cu-Ag合金中加1L 4mol/L的HNO3溶液,充分反应后只收集到NO气体,则反应后溶液的NO3-的物质的量浓度是多少?(忽略体积的变化)
考点:化学方程式的有关计算
专题:计算题
分析:可以设混合物中Cu xmol,Ag ymol,根据质量守恒根据质量一个等式,根据HNO3的物质的量等于酸性的硝酸和氧化性的硝酸之和列一个等式,联列方程组,根据分析解题.
解答:
解:设Cu xmol,Ag ymol,由合金质量为172g,得64x+108y=172,根据电子得失守恒可知生成一氧化氮的物质的量为:
mol,HNO3的物质的量一个等式2x+y+
=4,将两个式子联列方程组得:x=1,y=1,所以NO3-的物质的量浓度为:
=3mol/L,
答:溶液的NO3-的物质的量浓度是3mol/L.
| 2x+y |
| 3 |
| 2x+y |
| 3 |
4mol/L×1L-
| ||
| 1L |
答:溶液的NO3-的物质的量浓度是3mol/L.
点评:本题考查硝酸的性质以及化学方程式的有关计算,题目难度中等,注意从电子守恒和质量守恒的角度解答该题.

练习册系列答案
相关题目
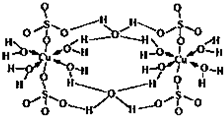 胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图:下列说法正确的是 ( )
胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图:下列说法正确的是 ( )| A、在上述物质的溶液中滴加BaCl2溶液无现象 |
| B、在上述结构示意图中,存在配位键、共价键和离子键 |
| C、胆矾是分子晶体,分子间存在氢键 |
| D、胆矾中的结晶水在不同温度下会逐渐失去 |
下列有机物属于烃的是( )
| A、C2H6 |
| B、CH3COOH |
| C、C2H5OH |
| D、CCl4 |
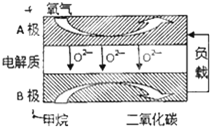
 为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线.请分析讨论以下问题.
为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线.请分析讨论以下问题.
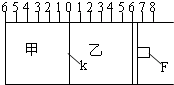 (Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2mol A和1mol B,乙中充入2mol C和1mol He,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:
(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2mol A和1mol B,乙中充入2mol C和1mol He,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题: