题目内容
【题目】钴的合金及其配合物用途非常广泛。
(1) Co3+基态核外电子排布式为________。
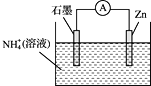
(2) 一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图所示,该金属间化合物的化学式为________。

(3) BNCP可用于激光起爆器等,BNCP可由HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为________ (用文字描述)。
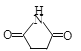
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是________ (已知CO32-的结构式为![]() )。
)。
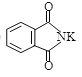
③NaNT可由![]() (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________,1 mol该分子中含σ键的数目为________。
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________,1 mol该分子中含σ键的数目为________。
【答案】[Ar]3d6或1s22s22p63s23p63d6 Pt3Co 正四面体 N和O sp和sp2 9 NA
【解析】
(1)Co元素为27号元素,Co原子失去4s能级上2个电子、3d能级上1个电子生成Co3+,根据构造原理书写该离子核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6;
(2)根据均摊法,该晶胞中Pt原子的个数为![]() =3,Co原子个数为
=3,Co原子个数为![]() =1,所以化学式为Pt3Co;
=1,所以化学式为Pt3Co;
(3)①ClO4-的中心原子价层电子对数为![]() =4,不含孤电子对,所以空间构型为正四面体;
=4,不含孤电子对,所以空间构型为正四面体;
②CTCN的化学式为[Co(NH3)4CO3]NO3,内界为[Co(NH3)4CO3]+,NH3分子中N原子含有孤电子对,根据碳酸根的结构式可知O原子有孤电子对,所以与Co(Ⅲ)形成配位键的原子是N和O;
③双聚氰胺C原子分别形成三键和双键,所以为sp杂化和sp2杂化;双键中有一个σ键,三键中有一个σ键,单键均为σ键,所以1 mol该分子中含σ键的数目为9 NA。

【题目】元素X、Y、 Z、W、Q、 M在元素周期表的相对位置如图所示,其中Z元素是目前发现的非金属性最强的元素,下列说法正确的是
X | Y | Z | |
W | Q | M |
A. 对应氢化物的沸点Y> Q是因为Y的非金属性比Q强
B. XM4的比例模型为![]() 其二氢取代物有两种
其二氢取代物有两种
C. W的氧化物,常温下可以和Z、M的氢化物反应
D. Z的单质能将Y的单质从他的氢化物中置换出来
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)![]() C8H8(g)+H2(g) ΔH=+125kJ·mol-1
C8H8(g)+H2(g) ΔH=+125kJ·mol-1
Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)该温度下,该反应的化学平衡常数K=________________。
(2)若保持其他条件不变,用0.40molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是________________,通过计算说明此时,该反应是否达到了平衡状态__________?