题目内容
5.(I)下列离子均为中学化学常见的离子:Na+、Ba2+、Mg2+、Al3+、Fe3+、Cu2+、Cl-、NO3-、CO32-、HCO3-、SO32-.上述离子中,在强酸性溶液里不可能大量存在的是CO32-、HCO3-、SO32-;在强碱性溶液中不可能大量存在的离子有Mg2+、Al3+、Fe3+、Cu2+;既不能在强酸性溶液里大量存在,也不能在强碱性溶液里大量存在的是HCO3-;无论在强酸性溶液还是强碱性溶液里,都可以大量存在的是Na+、Ba2+、Cl-、NO3-(Ⅱ)将适当的物质填在下边的横线上
(1)Cu2++Fe=Fe2++Cu;
(2)HCO3-+OH-=CO32-+H2O.
分析 (Ⅰ)与H+能反应的弱酸根离子、OH-,在强酸性溶液里不可能大量存在;与OH-能反应的弱碱阳离子、H+,在强碱性溶液中不可能大量存在;既不能在酸性较强溶液里、又不能在碱性较强的溶液里大量存在,说明离子和酸碱都反应;既能在酸性较强溶液里、又能在碱性较强的溶液里大量存在,说明不是弱酸阴离子和弱碱阳离子;
(Ⅱ)(1)Fe与铜离子发生置换反应;
(2)HCO3-与OH-反应生成水和CO32-.
解答 解:(Ⅰ)与H+能反应的弱酸根离子、OH-,在强酸性溶液里不可能大量存在,则CO32-、HCO3-、SO32-、OH-在强酸性溶液里不可能大量存在;与OH-能反应的弱碱阳离子、H+,在强碱性溶液中不可能大量存在,则Mg2+、Al3+、Fe3+、Cu2+、在强碱性溶液中不可能大量存在;HCO3-和酸碱都反应,既不能在酸性较强溶液里、又不能在碱性较强的溶液里大量存在;既能在酸性较强溶液里、又能在碱性较强的溶液里大量存在,说明不是弱酸阴离子和弱碱阳离子;Na+、Ba2+、Cl-、NO3-既能在酸性较强溶液里、又能在碱性较强的溶液里大量存在;
故答案为:CO32-、HCO3-、SO32-;Mg2+、Al3+、Fe3+、Cu2+;HCO3-;Na+、Ba2+、Cl-、NO3-;
(Ⅱ)(1)Fe与铜离子发生置换反应生成二价铁离子和铜单质,则其离子方程式为:Cu2++Fe=Fe2++Cu,故答案为:Fe;Cu;
(2)碳酸氢钠为可溶性盐,氢氧化钠为一元强碱,二者反应生成碳酸钠和水,反应的离子方程式为:HCO3-+OH-═H2O+CO32-,故答案为:OH-;H2O.
点评 本题考查了离子性质和离子反应,为高频考点,侧重学生分析能力的考查,注意把握反应的离子方程式,明确离子之间的反应是解题关键,题目难度中等.

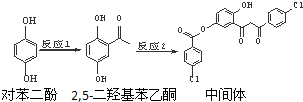
| A. | 对苯二酚和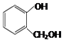 互为同系物 互为同系物 | |
| B. | 1 mol该中间体最多可与7 mol氢氧化钠反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、水解等反应 | |
| D. | 该中间体分子含有羰基和羟基两种含氧官能团 |
| A. | 平衡常数减小 | B. | CaO的量减少 | C. | 氧气浓度不变 | D. | CaO2的量不变 |
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 12种 |
| A. | 碘的升华 | B. | 用CCl4萃取溴水中的溴 | ||
| C. | AgBr感光 | D. | 浓盐酸的挥发 |
| A. | 14gC2H4中含有2m个C-H键 | |
| B. | 1mol.L-1 NH3•H2O溶液中含有nA个NH4+ | |
| C. | 1molNa2O2和足量CO2反应产生nA个O2分子 | |
| D. | 常温常压下,22.4L的SO2中含有nA个SO2分子 |

 .
. 、、
、、 或
或 .
.