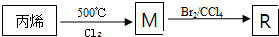
题目内容
10.下列试剂中,属于纯净物的是( )| A. | 稀硫酸 | B. | 石灰水 | C. | 蒸馏水 | D. | 肥皂水 |
分析 纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质;据此结合常见物质的组成成分逐项分析即可.
解答 解:A.稀硫酸是硫酸的水溶液是混合物,故A错误;
B.石灰水是氢氧化钙的水溶液是混合物,故B错误;
C.蒸馏水是氢、氧两种元素组成的纯净物,化学式为H2O,故C正确;
D.肥皂水是硬质酸钠的水溶液为混合物,故D错误;
故选C.
点评 本题考查了纯净物和混合物的区别,抓住物质是由几种物质组成的是解答本题的关键,如果只有一种物质组成就属于纯净物,如果有多种物质就属于混合物,题目难度不大.

练习册系列答案
相关题目
20.已知A、B、C、D、E、G都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.G3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:
(1)写出G基态原子的电子排布式1s22s22p63s23p63d64s2,G位于周期表d区;画出B基态原子外围电子的电子排布图 .
.
(2)A、B、C的第一电离能由小到大的顺序为C<O<N;电负性由小到大的顺序为C<N<O.(用相应的元素符号表示)
(3)G和Mn(质子数为25)两元素的部分电离能数据列于下表:
请回答:
①Mn基态原子的外围电子排布式为3d54s2,核外电子有25种不同的运动状态,占据7种不同能量的原子轨道.
②比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态G2+再失去一个电子难,对此,合理的解释是?Mn2+的3d轨道电子排布为半满状态较稳定,而Fe2+再失去一个电子形成Fe3+的3d轨道电子排布为半满状态较稳定?.
(1)写出G基态原子的电子排布式1s22s22p63s23p63d64s2,G位于周期表d区;画出B基态原子外围电子的电子排布图
 .
.(2)A、B、C的第一电离能由小到大的顺序为C<O<N;电负性由小到大的顺序为C<N<O.(用相应的元素符号表示)
(3)G和Mn(质子数为25)两元素的部分电离能数据列于下表:
| 元素 | Mn | G | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
①Mn基态原子的外围电子排布式为3d54s2,核外电子有25种不同的运动状态,占据7种不同能量的原子轨道.
②比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态G2+再失去一个电子难,对此,合理的解释是?Mn2+的3d轨道电子排布为半满状态较稳定,而Fe2+再失去一个电子形成Fe3+的3d轨道电子排布为半满状态较稳定?.
18.关于下列图象及其相关说法正确的是( )
| A. |  根据图可判断:2O3(g)=3O2(g);△H=-44.8KJ/mol | |
| B. |  根据图可判断A(g)?2C(g)在使用催化剂时的反应速率大,且面积Saco>Sbdo | |
| C. | 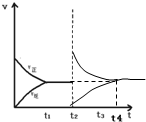 根据图可判断2A(g)?C(g)在恒温恒压时再充入A(g),t4重新达到平衡时与上一平衡为等效平衡 | |
| D. |  图表示2NO2(g)?N2O4(g)反应,当其它条件相同时,改变压强达到平衡时C(NO2)变化情况,且P1>P2 |
15.下列说法中,正确的是( )
| A. | 冰融化是化学变化 | B. | 电解水的过程是物理变化 | ||
| C. | 植物的光合作用是化学变化 | D. | 焰色反应是化学变化 |
2.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25 NA | |
| B. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成56g N2时,转移的电子数目为3.75NA |
19.化学实验必须注意安全,下列做法存在安全隐患的是( )
| A. | 氢气还原氧化铜实验中,先通氢气后加热氧化铜 | |
| B. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| C. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| D. | 在制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞 |