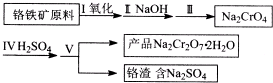
题目内容
11.下列离子方程式改写成化学方程式正确的是( )| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-═CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-═H2O 2KOH+H2SO4═K2SO4+2H2O |
分析 A.碳酸铜与氢氧化钠不反应;
B.碳酸钡为沉淀,应保留化学式;
C.Ca2++CO32-═CaCO3↓表示可溶性钙盐与可溶性碳酸盐反应只生成碳酸钙沉淀;
D.H++OH-═H2O表示强酸与强碱反应只生成水.
解答 解:A.Cu2++2OH-═Cu(OH)2↓可表示方程式:CuCl2+2NaOH═Cu(OH)2↓+2NaCl,故A错误;
B.BaCO3+2HCl═BaCl2+CO2↑+H2O,离子方程式为:BaCO3+2H+═CO2↑+H2O+Ba2+,故B错误;
C.Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3离子方程式:Ca2++CO32-═CaCO3↓,故C正确;
D.2KOH+H2SO4═K2SO4+2H2O,离子方程式:H++OH-═H2O,故D正确;
故选:CD.
点评 本题考查了离子方程式的书写,明确反应的实质是解题关键,注意离子方程式书写应符合客观规律、应遵循原子个数、电荷数守恒.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
2.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25 NA | |
| B. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成56g N2时,转移的电子数目为3.75NA |
19.化学实验必须注意安全,下列做法存在安全隐患的是( )
| A. | 氢气还原氧化铜实验中,先通氢气后加热氧化铜 | |
| B. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| C. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| D. | 在制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞 |
6.新型镁铝合金(Mg17Al12)有储氢性能,它一定条件下完全吸氢的反应为:Mg17Al12+17H2═17MgH2+12Al,得到的混合物Y(17MgH2+12Al)能与酸反应释放出大量氢气.下列说法正确的是( )
| A. | 该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成 | |
| B. | 该合金中含有离子键,铝元素呈正价 | |
| C. | 1mol Mg17Al12完全吸氢后得到的Y与盐酸完全反应放出H2在标准状况下的体积为1164.8L | |
| D. | 合金的熔点高于金属镁、金属铝的熔点 |
5.下列图示实验操作正确的是( )
| A. |  除去CL2中的HCL | B. |  电解制CL2和H2 | C. | 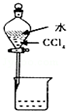 分离CCL4和水 | D. |  中和热的测定 |
 A,B,C,D,E是原子序数依次增大的五种短周期元素,A是半径最小的元素,C是半径最大的元素.B和D分别为同主族,且D的质子数是B的2倍,A与E形成的化合物的化学式为AE,其分子中含18个电子,请回答下列问题:
A,B,C,D,E是原子序数依次增大的五种短周期元素,A是半径最小的元素,C是半径最大的元素.B和D分别为同主族,且D的质子数是B的2倍,A与E形成的化合物的化学式为AE,其分子中含18个电子,请回答下列问题: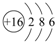 .
.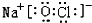 ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.