题目内容
1.标况下有34g NH3,则:(1)该气体含有的分子数约为1.204×1024个;
(2)该气体占有的体积约为44.8L;
(3)将该气体完全溶解于水配成2L溶液,其物质的量浓度为1mol/L;
(4)配制500mL 0.01mol/L Na2CO3溶液,应用托盘天平称取十水碳酸钠晶体(Na2CO3•10H2O)1.4g.
分析 (1)根据n=$\frac{m}{M}$计算氨气物质的量,再根据N=nNA计算分子数目;
(2)根据V=nVm计算氨气的体积;
(3)根据c=$\frac{n}{V}$计算溶液物质的量浓度;
(4)根据n=cV计算碳酸钠物质的量,十水碳酸钠晶体与碳酸钠的物质的量相等,根据m=nM计算十水碳酸钠晶体的质量.
解答 解:(1)氨气物质的量为$\frac{34g}{17g/mol}$=2mol,分子数目为2mol×6.02×1023mol-1=1.204×1024,故答案为:1.204×1024;
(2)根标况下,氨气的体积为2mol×22.4L/mol=44.8L,故答案为:44.8L;
(3)溶液物质的量浓度为$\frac{2mol}{2L}$=1mol/L,故答案为:1;
(4)碳酸钠物质的量为0.5L×0.01mol/L=0.005mol,十水碳酸钠晶体与碳酸钠的物质的量相等,需要十水碳酸钠晶体的质量为0.005mol×286g/mol≈1.4g,故答案为:1.4.
点评 本题考查物质的量有关计算,难度不大,(4)为易错点,计算结果应保留一位小数,学生容易忽略用托盘天平称量.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
12.下列表达方式错误的是( )
| A. | CO2的分子模型示意图: | |
| B. | 甲烷的电子式  | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p6 | |
| D. | 碳-12原子构成${\;}_{6}^{12}$C |
9.在体积固定不变的密闭容器中,充入2molNO和1molO2,在一定条件下达到平衡时,NO的转化率为95%,此时容器内的压强与开始时的压强之比是( )
| A. | 等于$\frac{2.05}{3}$ | B. | 小于$\frac{2.05}{3}$ | C. | 大于$\frac{2.05}{3}$ | D. | 等于$\frac{2}{3}$ |
13.在由水电离产生的c(H+)=1×10-14mol•L-1的溶液中,一定可以大量共存离子组是( )
| A. | NH4+、Al3+、Br-、SO42- | B. | Na+、Mg2+、Cl-、NO3- | ||
| C. | K+、Ba2+、Cl-、NO3- | D. | K+、Na+、SO42-、SO32- |
18.对可逆反应2SO2+O2?2SO3,下列叙述正确的是( )
| A. | 达平衡时若两种反应物的转化率相等,则起始投入的n(SO2):n(O2)=2:1 | |
| B. | 反应达到平衡后,缩小容器体积,正反应速率加快,逆反应速率减慢,平衡正向移动 | |
| C. | 反应达到平衡后,再加人催化剂.平衡不移动,反应速率不变 | |
| D. | 当v正(SO2):v正(SO3)=1:1时.说明该反应已经达到平衡 |
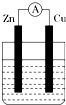 如图所示装置,烧杯中盛有200mL 1mol•L-1的CuSO4溶液.
如图所示装置,烧杯中盛有200mL 1mol•L-1的CuSO4溶液. 与
与 ,③金刚石与石墨,④乙醇(CH3-CH2-OH)与二甲醚(CH3OCH3).
,③金刚石与石墨,④乙醇(CH3-CH2-OH)与二甲醚(CH3OCH3).