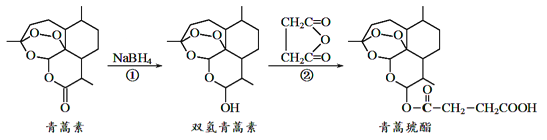
题目内容
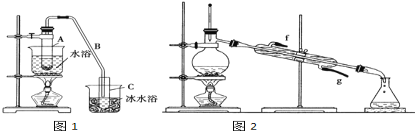
【题目】化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯。
已知:
相对分子质量 | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 100 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 82 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品:
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止暴沸),缓慢加热至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是_________.
②试管C置于冰水浴中的目的是____________________________.
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静止、分层,环己烯在______层(填“上”或“下”),分液后用_______(填选项字母)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,蒸馏时要加入生石灰,目的是__________________________.
③蒸馏收集产品时,实验制得的环己烯精品质量低于理论产量,可能的原因是_______(填选项字母).
a. 蒸馏时从70℃开始收集产品 b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出。
(3)以下区分环己烯精品和粗品的方法,合理的是_______(填选项字母)。
a. 分别加入用金属钠 b. 分别加入酸性高锰酸钾溶液
c. 分别测定沸点 d. 分别加入FeCl3溶液
(4)如果最终得到纯净环己烯产品质量为8.2 g, 则该实验所得到的环己烯产率是___________(保留3位有效数字)。
【答案】 冷凝 使环己烯液化,减少挥发 上 c 除去环己烯中少量的水(或干燥) c a c 83.3%
【解析】(1)①根据实验室制乙烯可以知道,导管B比较长,能增加与空气的接触面积,其作用是导气和将生成的气体物质冷凝回流;②冰水浴的目的是降低环己烯蒸气的温度,使其液化;
(2)①环己烯不溶于水,且密度比水小,振荡、静置、分层后环己烯在上层;除酸性杂质选碱性物质;
②生石灰能与水反应生成氢氧化钙,除去了残留的水,得到纯净的环己烯;
③若在制备粗品时环已醇随产品一起蒸出,环已醇的利用率下降,则实验制得的环己烯精品质量低于理论产量。
(3)环己烯粗品中含有环己醇,根据环己醇能与钠产生氢气,而环己稀不能,二者的沸点不同,据此选择;
(4)据反应 可知,12g
可知,12g 理论上可制得
理论上可制得![]() 的质量为
的质量为![]() =9.84g,而实际得到8.2g,故产率为
=9.84g,而实际得到8.2g,故产率为![]() =83.3%
=83.3%
详解:(1)根据实验室制乙烯可以知道,导管B比较长,能增加与空气的接触面积,其作用是导气和将生成的气体物质冷凝回流;
因此,本题正确答案是:冷凝;
(2)冰水浴的目的是降低环己烯蒸气的温度,使其液化;
因此,本题正确答案是:使环己烯液化,减少挥发;
(2)①环己烯不溶于水,且密度比水小,振荡、静置、分层后环己烯在上层;由于分液后环己烯粗品中还含有少量的酸和环己醇,联想制备乙酸乙酯提纯产物时用c(Na2CO3溶液)洗涤可除去酸,不能用酸性高锰酸钾,否则会氧化环己烯,故答案为:上;c;
②生石灰能与水反应生成氢氧化钙,除去了残留的水,得到纯净的环己烯;故答案为: 除去环己烯中少量的水(或干燥) ;
③A、蒸馏时从70℃开始收集产品,提前收集,产品中混有杂质,实际产量高于理论产量,故A错误;
B、环己醇实际用量多了,制取的环己烯的物质的量增大,实验制得的环己烯精品质量高于理论产量,故B错误;
C、若粗产品中混有环己醇,导致测定消耗的环己醇量增大,制得的环己烯精品质量低于理论产量,故C正确;故选C;故答案为:C;
(3)环己烯粗品中含有环己醇,根据环己醇能与钠产生氢气,而环己稀不能,加入FeCl3溶液观察实验现象,环己烯精品和粗品没有区别,环己烯精品和粗品都能使高锰酸钾褪色,环己烯和环己醇沸点不同,故选 a c 。
(4)12.5 mL环己醇的质量为12.5 mL×0.96 g cm-3=12g,理论上生成环已烯![]() ×82g/mol=9.84g,产率=
×82g/mol=9.84g,产率=![]() ×100%=83.3%,故答案为:83.3%。
×100%=83.3%,故答案为:83.3%。

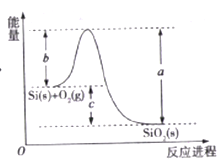
【题目】已知: ①1mol晶体硅中含有2molSi-Si键。②Si(s)+O2(g)=SiO2(s)ΔH,其反应过程与能量变化如图所示。
③
化学键 | Si-O | O=O | Si-Si |
断开1mol共价键所需能量/KJ | 460 | 500 | 176 |
下列说法正确的是
A. 晶体硅光伏发电是将化学能转化为电能的
B. 二氧化硅稳定性小于硅的稳定性
C. ΔH=-988 kJ/mol
D. ΔH=a-c
【题目】![]() 盐酸与
盐酸与![]() 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

回答下列问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器,这种玻璃仪器的名称是____________________。能否改用铜丝_______(填“能、否”),原因是____________________________
(2)大烧杯上如不盖硬纸板,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
(3)实验中改用![]() 盐酸跟
盐酸跟![]() 溶液进行反应,与上述实验相比,所放出的热量__________(填“偏大”“相等”或“偏小”),所求中和热__________(填“相等”或“不相等”)。
溶液进行反应,与上述实验相比,所放出的热量__________(填“偏大”“相等”或“偏小”),所求中和热__________(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替![]() 溶液进行上述实验,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
溶液进行上述实验,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
(5)取![]() 溶液和
溶液和![]() 硫酸溶液进行实验,实验数据如下表。
硫酸溶液进行实验,实验数据如下表。
温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值
| ||
|
| 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _________________ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
则中和热![]() __________(取小数点后一位。)(本题中
__________(取小数点后一位。)(本题中![]() 溶液和硫酸溶液的密度均取
溶液和硫酸溶液的密度均取![]() ,中和后生成溶液的比热容取
,中和后生成溶液的比热容取![]() )
)