题目内容
(1).等物质的量的CO和CO2中所含O原子个数之比 ,C原子数之比 ,二者的质量之比 。
(2)下列物质中:(1)Cu (2) Br2 ⑶Na2O ⑷蔗糖 ⑸NaCl溶液 ⑹ SO3 ⑺Ba(OH)2
属于电解质的是 , 属于非电解质的是 ,能导电的是 。(用序号填写)
(1)1﹕2, 1﹕1, 7﹕11 (2)⑶Na2O、⑺Ba(OH)2;⑷蔗糖、⑹ SO3 ;(1)Cu、⑸NaCl溶液
解析试题分析:在水溶液中或者是融熔状态下能够导电的化合物叫电解质,在水溶液中和在熔融状态下不能够导电的化合物叫非电解质,也就是说,非电解质也是化合物。
考点:考查电解质和物质的量。

练习册系列答案
相关题目
配制500 mL 0.5 mol/L的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为 。
(2)配制方法:设计五个操作步骤。
①向盛有NaOH固体的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm;
③将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④用少量的蒸馏水洗涤烧杯和玻璃棒2~3次,然后将洗涤液移入容量瓶;
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将操作步骤正确排序 。
(3)某学生实际配制NaOH溶液的浓度为0.48 mol/L,原因可能是 。
| A.使用滤纸称量氢氧化钠固体 |
| B.容量瓶中原来存在少量蒸馏水 |
| C.溶解后的烧杯未经多次洗涤 |
| D.胶头滴管加水定容时仰视刻度线 |

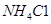 溶液和
溶液和 溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的
溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的
 H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。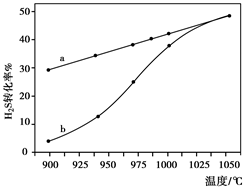
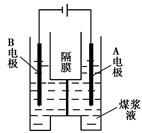
 2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算:
2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算: 