题目内容
测定水中溶液氧气的方法是:取a mL水样,迅速加入MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用Na2S2O3溶液(浓度b mol/L)和I2反应,消耗了VmL达到终点(以淀粉作指示剂)。有关方程式为:①2Mn2++O2+4OH-=2MnO(OH)2(反应很快);②MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;③I2+2S2O32-=S4O62-+2I-。
⑴需要进行滴定的反应是 ,终点的颜色变化为 。
⑵将Na2S2O3溶液盛放在 (“酸式”或“碱式”)滴定管中。
⑶在加入MnSO4溶液及含有NaOH的KI溶液和适量的稀硫酸时,要迅速的加入,否则将对结果造成 (“偏高”、“偏低”或“无影响”),原因是
。
⑷在加入MnSO4溶液及含有NaOH的KI溶液振荡时,塞子未塞紧,溅出部分溶液,则将对结果造成 (“偏高”、“偏低”或“无影响”),原因是
。
⑸水中溶液O2为(以m g/L为单位) 。
⑴需要进行滴定的反应是 ,终点的颜色变化为 。
⑵将Na2S2O3溶液盛放在 (“酸式”或“碱式”)滴定管中。
⑶在加入MnSO4溶液及含有NaOH的KI溶液和适量的稀硫酸时,要迅速的加入,否则将对结果造成 (“偏高”、“偏低”或“无影响”),原因是
。
⑷在加入MnSO4溶液及含有NaOH的KI溶液振荡时,塞子未塞紧,溅出部分溶液,则将对结果造成 (“偏高”、“偏低”或“无影响”),原因是
。
⑸水中溶液O2为(以m g/L为单位) 。
⑴③ 蓝色褪去;⑵碱式;⑶偏高 外界的空气进入,氧化Mn2+;⑷偏低 溅出部分溶液中含有O2;⑸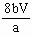 ×
×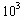 mg/L。
mg/L。
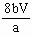 ×
×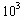 mg/L。
mg/L。⑴由于反应最后生成I2,所以进行滴定的反应应是③,而淀粉与I2呈蓝色,则滴定终点时应为蓝色褪去;⑵由于Na2S2O3溶液水解呈碱性,故应用碱式滴定管;⑶加入溶液时太慢,会使外界着的空气进入,使氧气增大,最终结果偏高;⑷溅出部分溶液中含有O2,氧化Mn2+的量减少,使最终结果偏小;⑸由反应①②③知,O2~4 S2O32-,则水中溶液O2的浓度为(以m g/L为单位):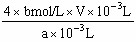 ×32g/mol×1000mg/g=
×32g/mol×1000mg/g=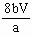 ×
×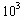 mg/L。
mg/L。
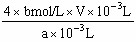 ×32g/mol×1000mg/g=
×32g/mol×1000mg/g=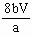 ×
×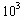 mg/L。
mg/L。
练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
