题目内容
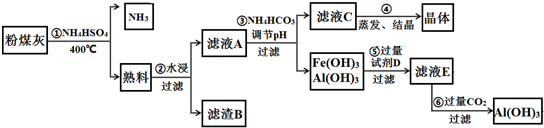
1.亚铁氰化钾(K4Fe(CN)6,黄血盐)在化学实验、电镀、食品添加剂及医学上有广泛用途.还可用于冶疗铊(Tl)中毒,烧制青花瓷时可用于绘画等.已知HCN是一种极弱的酸.现有一种用含NaCN废水合成黄血盐的主要工艺流程如图:
(1)NaCN的水溶液呈碱性,用离子方程式表示其原因CN-+H2O?HCN+OH-.实验室在用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于NaOH溶液,再用蒸馏水稀释.
(2)实验室K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6],生成的盐又可用于治疗Tl2SO4中毒,试写出上述检验Fe3+反应的离子方程式为K++[Fe(CN)6]4-+Fe3+=KFe[Fe(CN)6]↓.
(3)流程图中加入碳酸钠溶液主要目的是除去其中的Ca2+.
(4)相同温度下溶解度:Na4[Fe(CN)6]>K4[Fe(CN)6](选填:“>”、“=”、“<”).
(5)长期火炒添加有亚铁氰化钾的食盐,这时会发生分解反应,试配平下列方程式:3K4Fe(CN)6=12KCN+1Fe3C+1C+2(CN)2↑+1N2↑
(6)电镀银时,电镀液不能直接用硝酸银溶液,可将其转变为K4[Ag2 (CN)6],写出AgCl与黄血盐制取电镀液的离子方程式2AgCl+[Fe(CN)6]4-=Fe2++[Ag2 (CN)6]4-+2Cl-.
分析 实验目的是合成黄血盐,由流程可知,NaCN废液中加入硫酸亚铁、氯化钙,发生6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6+CaSO4↓+2NaCl,然后加入碳酸钠溶液可除去过量的Ca2+,经过滤后在滤液中加入KCl可转化生成K4[Fe(CN)6,说明K4[Fe(CN)6溶解度较小,以此解答该题.
(1)NaCN为强碱弱酸盐,溶液中CN-离子水解溶液呈碱性,NaCN水解呈碱性的离子方程式为:CN-+H2O?HCN+OH-,为抑制水解,在配制溶液时可将其溶解在氢氧化钠溶液中;
(2)NaCN废液中加入硫酸亚铁、氯化钙,发生6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6+CaSO4↓+2NaCl;
(3)反应器中加入氯化钙,需要加入碳酸钠除去;
(4)经过滤后在滤液中加入KCl可转化生成K4[Fe(CN)6,说明K4[Fe(CN)6溶解度较小;
(5)依据原子守恒和电子守恒配平书写化学方程式;
(6)AgCl与黄血盐制取电镀液可将其转变为K4[Ag2 (CN)6],结合电话守恒,原子守恒配书写.
解答 解:实验目的是合成黄血盐,由流程可知,NaCN废液中加入硫酸亚铁、氯化钙,发生6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6+CaSO4↓+2NaCl,然后加入碳酸钠溶液可除去过量的Ca2+,经过滤后在滤液中加入KCl可转化生成K4[Fe(CN)6,说明K4[Fe(CN)6溶解度较小,
(1)NaCN为强碱弱酸盐,溶液中CN-离子水解溶液呈碱性,NaCN水解呈碱性的离子方程式为:CN-+H2O?HCN+OH-,为抑制水解,在配制溶液时可将其溶解在氢氧化钠溶液中,在加水稀释,
故答案为:碱;NaOH;CN-+H2O?HCN+OH-;
(2)NaCN废液中加入硫酸亚铁、氯化钙,发生6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6+CaSO4↓+2NaCl,离子方程式为:K++[Fe(CN)6]4-+Fe3+=KFe[Fe(CN)6]↓,
故答案为:K++[Fe(CN)6]4-+Fe3+=KFe[Fe(CN)6]↓;
(3)反应器中加入氯化钙,加入碳酸钠溶液可除去过量的Ca2+,
故答案为:除去其中的Ca2+;
(4)经过滤后在滤液中加入KCl可转化生成K4[Fe(CN)6,说明K4[Fe(CN)6溶解度较小,故答案为:>;
(5)依据K4Fe(CN)6的系数为3,结合原子守恒,Fe3C前系数为3,KCN前系数为12,电子守恒得到N2前系数为1,依据氮原子守恒,(CN)2前系数为2,碳原子守恒,C前系数为1,配平得到的化学方程式为:3K4Fe(CN)6=Fe3C+12KCN+N2↑+C+2(CN)2↑,
故答案为:12,1,1,2,1;
(6)电镀液不能直接用硝酸银溶液,可将其转变为K4[Ag2 (CN)6],AgCl与黄血盐制取电镀液可将其转变为K4[Ag2 (CN)6],反应的离子方程式为:2AgCl+[Fe(CN)6]4-=Fe2++[Ag2 (CN)6]4-+2Cl-,
故答案为:2AgCl+[Fe(CN)6]4-=Fe2++[Ag2 (CN)6]4-+2Cl-.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,注意根据流程图把握实验的原理和操作方法,难度中等,注意根据氧化还原反应的化合价的升降总数相等计算.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. | 3:2:1 | B. | 2:6:3 | C. | 3:6:2 | D. | 2:1:3 |
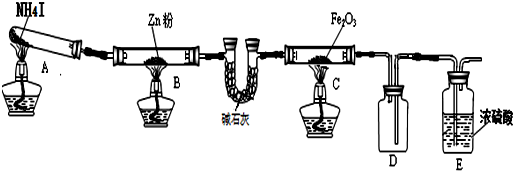
完成下列填空:
(1)实验时A中有大量紫红色的烟气,烟气的主要成份是NH3、H2、I2、HI,在上图装置中,碱石灰的作用是吸收混合气体中的HI;
(2)装置B中,Zn会与I2发生反应,其反应化学方程式Zn+I2═ZnI2
-;
(3)按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置C加热,反应产物均为黑色粉末 (纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无明显变化 |
| 3 | 向步骤2溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
(4)若装置C中反应后的固体是Fe2O3和FeO组成的混合物.为确定其组成,取样品7.84克,在加热 条件下通入足量的氨气,完全反应后,停止加热,Fe2O3和FeO都被还原为Fe,反应管中铁粉冷却后,称得质量为5.6克,则混合物中Fe2O3和FeO的物质的量之比为2:1.
| A. | 仅含有碳和氢两种元素的化合物称为烃 | |
| B. | 凡是分子里含碳元素的化合物都属于烃 | |
| C. | 甲烷可以使酸性高锰酸钾溶液褪色 | |
| D. | 有机化合物分子中碳原子之间只有单键 |
| A. | WZ2分子中所有原子最外层都为8电子结构 | |
| B. | WX2、ZX2的化学键类型相同 | |
| C. | 原子半径大小顺序为X<W<Y<Z | |
| D. | 非金属性Y<Z |
 等”);所求中和热的数值会______________(填“相等”或 “不相等”)。
等”);所求中和热的数值会______________(填“相等”或 “不相等”)。
 )通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。 O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1
O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1