题目内容
【题目】一种由CuO和KHC2O4溶液反应的到的蓝色结晶[KaCub(C2O4)cdH2O]。为测定其组成,进行了如下实验:
步骤1称取3.5400 g该晶体,加入过量稀硫酸,待样品完全溶解后加入适量水,配制成100 mL溶液A.
步骤2量取20.00 mLA溶液,滴加0.2000 mol L-1 KMnO4溶液至恰好完全反应时,消耗KMnO4溶液8.00 mL。
步骤3另取20.00 mLA溶液,加入足量NaOH溶液,充分反应后,经过滤、洗涤、灼烧、称重,得到黑色固体粉末0.16 g。
己知:步骤2 中发生反应:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ +10CO2↑ + 8H2O。
(1)步骤1中配制溶液A时,需要用到的玻璃仪器有烧杯、玻璃棒、_____。
(2)3.5400 g 该样品中含 n(C2O42-)= ____mol。
(3)3.5400 g 该样品中含 n(Cu2+)= ____mol。
(4)通过计算确定该蓝色晶体的化学式__________(计算过程)。
【答案】100 mL容量瓶、胶头滴管 0.02 0.01 3.5400 g 该样品中含 n(Cu2+)为0.01mol,含n(C2O42-)为0.02mol,由电荷守恒可知含n(K+) =2n(C2O42-)- 2n(Cu2+)=0.02mol,则含n(H2O) =![]() =0.02mol,则A中n(K+):n(Cu2+):n(C2O42-):n(H2O) =2:1:2:2,故化学式为K2Cu(C2O4)2·2H2O
=0.02mol,则A中n(K+):n(Cu2+):n(C2O42-):n(H2O) =2:1:2:2,故化学式为K2Cu(C2O4)2·2H2O
【解析】
(1)配制成100 mL溶液A的操作步骤为溶解、转移、洗涤、定容、装瓶,实验中用到的玻璃仪器有烧杯、玻璃棒、100 mL容量瓶、胶头滴管,故答案为:100 mL容量瓶(胶头滴管);
(2)由题给方程式可得关系式2MnO4-~5C2O42-,20.00 mLA溶液消耗高锰酸钾的物质的量为0.2×8×10-3mol,则3.5400 g 该样品中含 n(C2O42-)=0.2×8×10-3mol×5×![]() =0.02mol,故答案为:0.02;
=0.02mol,故答案为:0.02;
(3)由铜原子个数守恒可得关系式Cu2+~CuO,20.00 mLA溶液得到CuO的物质的量为![]() =0.002mol,3.5400 g 该样品中含 n(Cu2+)=0.002mol×5=0.01mol,答案为:0.01;
=0.002mol,3.5400 g 该样品中含 n(Cu2+)=0.002mol×5=0.01mol,答案为:0.01;
(4)3.5400 g 该样品中含 n(Cu2+)为0.01mol,含n(C2O42-)为0.02mol,由电荷守恒可知含n(K+) =2n(C2O42-)- 2n(Cu2+)=0.02mol,则含n(H2O) =![]() =0.02mol,则A中n(K+):n(Cu2+):n(C2O42-):n(H2O) =2:1:2:2,故化学式为K2Cu(C2O4)2·2H2O。
=0.02mol,则A中n(K+):n(Cu2+):n(C2O42-):n(H2O) =2:1:2:2,故化学式为K2Cu(C2O4)2·2H2O。

【题目】某科研小组采用电解锰粉(主要成分为Mn和少量含Fe、Ni、Pb、P、Si等元素的单质或其化合物)为原料制备高纯氯化锰。
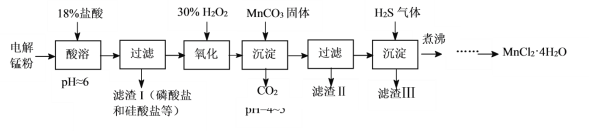
已知:①Mn是一种比Fe活泼的金属。
②H2S气体具有较强的还原性,如:H2S+H2O2=S↓+2H2O。
③相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
Fe3+ | Fe2+ | Mn2+ | Ni2+ | Pb2+ | |
开始沉淀的pH | 1.1 | 5.8 | 8.6 | 6.7 | 8.0 |
沉淀完全的pH | 3.2 | 8.8 | 10.1 | 9.2 | 8.8 |
(1)酸溶时盐酸要缓慢滴加的原因是___。
(2)加入MnCO3固体时发生反应的离子方程式为___。MnCO3固体也可用下列物质代替___。(填写编号)
A.MnO B.MnSO4 C.Mn(OH)2 D.MnCl2
(3)通入H2S气体可使Pb2+、Ni2+生成硫化物沉淀,如:H2S(aq)+Pb2+(aq)![]() PbS(s)+2H+(aq),该反应的平衡常数K=___[用Ka1(H2S)、Ka2(H2S)及Ksp(PbS)表示]。
PbS(s)+2H+(aq),该反应的平衡常数K=___[用Ka1(H2S)、Ka2(H2S)及Ksp(PbS)表示]。
(4)煮沸的目的是___。
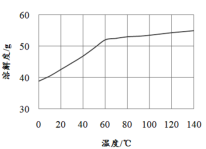
(5)已知MnCl2·4H2O在106℃时失去一分子结晶水,198℃失去全部结晶水。请补充完整由煮沸后的滤液获得高纯(>99.99%)MnCl2·4H2O晶体(MnCl2的溶解度曲线如图所示)的实验方案:将煮沸后的滤液冷却至室温,___(实验中须使用的试剂是:30%H2O2)。