题目内容
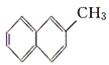
【题目】废物的处理、转化和利用是非常有意义的。某研究性学习小组设计如图所示流程,综合处理某工厂印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)和废气(H2S),真正做到了变废为宝:处理废液、废气得到氯化铜、单质硫的同时,还实现了蚀刻液的循环利用。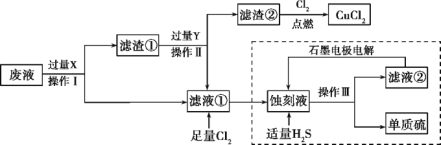
根据以上信息回答下列问题:
(1)操作I、Ⅱ、Ⅲ相同,名称是__,所需要的玻璃仪器主要有:烧杯、玻璃棒、__。
(2)通常用来检验蚀刻液中金属阳离子的化学试剂是__。
(3)向废液中加入过量X时发生的主要反应的离子方程式为__。
(4)滤渣①与Y反应的化学方程式为____。
(5)H2S通入蚀刻液中发生的主要反应为___。
(6)电解池中H+在阴极放电产生H2,阳极的电极反应式为__。
(7)综合分析虚线框内所涉及的两个反应,可知该过程有两个显著优点:①蚀刻液得到循环利用;②__。
【答案】过滤 漏斗 KSCN溶液 2Fe3++Fe=3Fe2+,Cu2++Fe=Fe2++Cu Fe+2HCl=FeCl2+H2↑ 2FeCl3+H2S=2FeCl2+S↓+2HCl 或2Fe3++H2S=2Fe2++S↓+2H+ 2Fe2+-2e-=2Fe3+ 硫化氢的原子利用率为100%
【解析】
根据流程图,滤液①中通入足量的氯气,能够生成蚀刻液(FeCl3),因此滤液①为FeCl2,则废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的X为铁粉,三价铁离子与铁反应生成二价铁离子,铜离子与铁反应生成铜和二价铁离子,经过过滤得到滤渣①为铜与铁,滤液①为氯化亚铁溶液,滤渣①中加入过量的Y得到氯化亚铁溶液,因此Y为盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,过滤得到滤渣②为铜,铜与氯气反应生成氯化铜,滤液①通入足量氯气生成氯化铁,氯化铁与硫化氢反应生成硫单质和氯化亚铁,过滤得到单质硫和滤液②为氯化亚铁,电解可以生成氯化铁。据此分析解答。
(1)由流程图可知,操作Ⅰ、Ⅱ、Ⅲ都是分离固体与液体的操作,应为过滤操作,用到的玻璃仪器主要有:烧杯、玻璃棒、漏斗,缺少的仪器为:漏斗,故答案为:过滤;漏斗;
(2)滤渣②与氯气反应得到氯化铜,则滤渣②为铜,氯化铁与铜反应生成氯化铁和氯化铜,所以刻蚀液主要为三氯化铁,检验三价铁离子,可以用KSCN溶液,如果加入KSCN溶液出现血红色,证明含有三价铁离子,故答案为:KSCN溶液;
(3)根据上述分析,X为铁,铁能够与溶液中三价铁离子,铜离子发生反应,离子方程式依次是:2Fe3++Fe=3Fe2+,Cu2++Fe=Fe2++Cu,故答案为:2Fe3++Fe=3Fe2+,Cu2++Fe=Fe2++Cu;
(4)滤渣①为铜和过量的铁,除去铁,应加入过量的盐酸,所以Y为盐酸,铜与盐酸不反应,铁与盐酸反应生成氯化亚铁,反应的化学方程式:Fe+2HCl=FeCl2+H2↑,故答案为:Fe+2HCl=FeCl2+H2↑;
(5)刻蚀液为氯化铁,通入硫化氢发生氧化还原反应,反应的化学方程式为:,离子方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl,故答案为:2FeCl3+H2S=2FeCl2+S↓+2HCl 或2Fe3++H2S=2Fe2++S↓+2H+;
(6)氯化铁与硫化氢反应生成硫单质和氯化亚铁、氯化氢,过滤得到滤渣为硫单质,滤液为氯化亚铁和盐酸,电解二者的混合物,阳极上Fe2+失去电子发生氧化反应生成Fe3+,电极反应式为:2Fe2+-2e-=2Fe3+,故答案为:2Fe2+-2e-=2Fe3+;
(7)依据氯化铁与硫化氢反应可知硫化氢在反应中原子利用率为100%,故答案为:硫化氢的原子利用率为100%。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案