题目内容
【题目】以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法正确的是

A. 放电时,Mo箔上的电势比Mg箔上的低
B. 充电时,Mo箔接电源的负极
C. 放电时,正极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
D. 充电时,外电路中通过0.2mol电子时,阴极质量增加3.55g
【答案】C
【解析】
A. 放电时,Mg作负极,Mo作正极,所以Mo箔上的电势比Mg箔上的高,故A错误;B.充电时,电池的负极接电源的负极,电池的正极接电源的正极,即Mo箔接电源的正极,故B错误;C.根据原电池工作原理,放电时Mg作负极,Mo作正极,正极反应式为Fe[Fe(CN)6]+2Na+ +2e - = Na2Fe[Fe(CN)6], 故C正确; D.放电时负极上应是2Mg-4e - +2C1-=[Mg2Cl2]2+,通过0.2mol电子时,消耗0.1 mol Mg,质量减少2.4g,则充电时质量增加2.4g,故D错误。答案:C。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】一氧化二氯(Cl2O)是一种氯化剂和氧化剂,极易溶于水,与水反应生成HClO,遇有机物易燃烧或爆炸,42℃以上易分解。某化学兴趣小组设计如图装置以制备Cl2O(支撑及夹持装置已省略)。
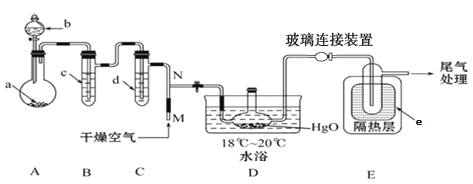
已知:① a中固体试剂是MnO2,b中试剂是浓盐酸。 ②Cl2O的部分性质如下表。
熔点 | 沸点 | 制备方法 |
-120.6 ℃ | 3.8℃ | 2HgO+2Cl2 = Cl2O+HgCl2·HgO |
请回答:
(1)指出该制备装置中存在的一个明显错误______________(经改进后进行有关实验)。
(2)装置C中盛有的试剂是______________。
(3)写出装置A中制备Cl2的化学方程式__________。
(4)装置D中采用18℃~20℃水浴的原因之一是如温度过低,反应速率慢,另一个可能的原因是 ___________。
(5)装置D、E间的连接方式与A、B、C间的连接方式有明显的差别,装置D、E间采用这种连接方式的理由是____________。
(6)Cl2O是市场上一种比较理想的饮水消毒剂,ClO2和Cl2O在消毒时自身均被还原为Cl-,则ClO2消毒能力是等质量Cl2O的_________倍(结果保留两位小数)
(7)文献报道说,Cl2O的另一种制备方法是利用Cl2与足量的Na2CO3溶液反应来制得,写出该反应的化学方程式:_________。