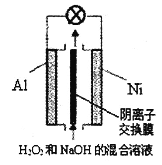
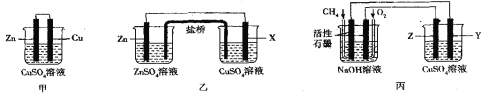
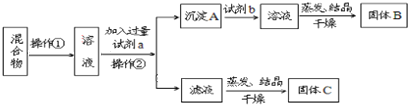
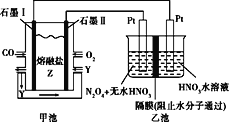
��Ŀ����
����Ŀ��25��ʱ������һ��c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)=0.100 mol��L��1��H3PO4��NaOH�����Һ����Һ�в����������ʵ���Ũ����pH�ı仯������ͼ��ʾ������ָ����Һ���������ʵ���Ũ�ȹ�ϵһ����ȷ����
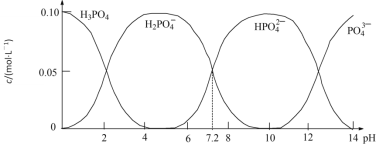
A.pH=6����Һ�У�c(H3PO4)+c(HPO42-)��c(H2PO4-)
B.c(Na+)=0.100mol��L��1����Һ�У�c(H3PO4)=2c(PO43-)+c(HPO42-)
C.pH =7����Һ�У�c(Na+)��2c(HPO42-)+c(H2PO4-)
D.c(H3PO4)=c(H2PO4-)����Һ�У�c(Na+)��0.100mol��L��1 +2c(PO43-)+c(HPO42-)
���𰸡�CD
��������
A��pH��6 ����Һ��Ҫ��H2PO4������Һ����ʱ�����ѳ�ַ�Ӧ��c(H3PO4)+c(HPO42��)��c(H2PO4��)����A����
B��c(Na+)��0.100 molL��1����Һ��c(PO43��)+c(HPO42��)+c(H2PO4��)��0.100molL��1��c(Na+)����Һ��������Ҫ��NaH2PO4����ͼ���֪��H2PO4����ˮ��̶�С�ڵ���̶ȣ����ɵ�H3PO4���٣���2c(PO43��)+c(HPO4��)��c(H3PO4)����B����
C��pH��7.2����ҺΪ��Ũ�ȵ�NaH2PO4��Na2HPO4��pH��7 ����ҺNaH2PO4��Ũ���Դ���Na2HPO4����Һ������Ũ��c(Na+)��2c(HPO42��)��c(H2PO4��)����C��ȷ��
D��c(H3PO4)��c(H2PO4��)����ҺpH��2����c(H+)��c(OH��)����Һ�д��ڵ���غ㣺c(Na+)+c(H+)��c(OH��)+c(H2PO4��)+2c(HPO42��)+3c(PO43��)��c(PO43��)+c(HPO42��)+c(H2PO4��)��0.100molL��1���õ�c(Na+)��0.100molL��1+2c(PO43��)+c(HPO42��)����D��ȷ��
�ʴ�ΪCD��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�