题目内容
【题目】(1)2017年5月,我国在南海成功开采“可燃冰”(甲烷水合物),标志着在技术方面取得了突破性进展。甲烷是优质的清洁能源,综合开发利用能有效缓解大气污染问题。
已知:CH4(g)+2O2(g)=CO2(g) +2H2O(g) ΔH =- 802 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH =-566kJ·mol-1
H2O(g)=H2O(l) ΔH =- 44kJ·mol-1
则1mol CH4(g)不完全燃烧生成CO和H2O(l) 的热化学方程式为:___________________________。
(2)甲烷转化为CO和H2的反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH>0。
CO(g)+3H2(g) ΔH>0。
①一定条件下,CH4的平衡转化率与温度、压强的关系如下图1所示。则P1________P2(填“<”、“>”或“=”) ;A、B、C 三点处对应的平衡常数(KA、KB、KC)由大到小的顺序为___________________。
②将CH4和H2O(g)按等物质的量混合,一定条件下反应达到平衡,CH4转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为________________。

(3)甲烷燃料电池工作原理如上图2所示。a气体是______________,b气体通入电极的反应式为__________。用该燃料电池作电源、以石墨作电极电解硫酸铜溶液,一段时间后,若将0.1mol Cu2(OH)2CO3溶解于该溶液,恰好使溶液恢复至起始成分和浓度,则燃料电池中理论上消耗CH4的体积(标准状况)为_________________。
(4)25℃时,H2CO3的电离常数分别为:Ka1=4.4×10-7mol·L-1;Ka2=5.0×10-11 mol·L-1。在20mL0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液20mL,所得溶液pH=8。此溶液中各阴离子的物质的量浓度大小关系为__________________,![]() =__________________。
=__________________。
【答案】 CH4(g)+3/2O2(g)===CO(g)+2H2O(l) ΔH=-607 kJ/mol < KC>KB>KA 3:2(或:1.5) O2(或氧气) CH4+2H2O-8e-===CO2+8H+ 1.68 L c(Cl-)>c(HCO3-)>c(OH-)>c(CO32-) 或:c(CO32-)<c(OH-)<c(HCO3-)<c(Cl-) 200
【解析】(1)①CH4(g)+2O2(g)=CO2(g) +2H2O(g) ΔH =- 802 kJ·mol-1,②2CO(g)+O2(g)=2CO2(g) ΔH =-566kJ·mol-1,③H2O(g)=H2O(l) ΔH =- 44kJ·mol-1,根据盖斯定律,将①-![]() ×②+③×2得:CH4(g)+3/2O2(g)===CO(g)+2H2O(l) ΔH=(- 802 kJ·mol-1)-(-566kJ·mol-1)×
×②+③×2得:CH4(g)+3/2O2(g)===CO(g)+2H2O(l) ΔH=(- 802 kJ·mol-1)-(-566kJ·mol-1)×![]() +(- 44kJ·mol-1)×2=-607 kJ/mol,故答案为:CH4(g)+3/2O2(g)===CO(g)+2H2O(l) ΔH=-607 kJ/mol;
+(- 44kJ·mol-1)×2=-607 kJ/mol,故答案为:CH4(g)+3/2O2(g)===CO(g)+2H2O(l) ΔH=-607 kJ/mol;
(2)①根据CH4(g)+H2O(g)![]() CO(g)+3H2(g),相同温度下,增大压强,平衡逆向移动,CH4的平衡转化率减小,结合图像可知P1<P2;该反应为吸热反应,升高温度,平衡正向移动,平衡常数增大,A、B、C 三点处对应的平衡常数由大到小的顺序为KC>KB>KA,故答案为:<;KC>KB>KA;
CO(g)+3H2(g),相同温度下,增大压强,平衡逆向移动,CH4的平衡转化率减小,结合图像可知P1<P2;该反应为吸热反应,升高温度,平衡正向移动,平衡常数增大,A、B、C 三点处对应的平衡常数由大到小的顺序为KC>KB>KA,故答案为:<;KC>KB>KA;
②将CH4和H2O(g)按等物质的量混合,假设均为1mol,
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始(mol) 1 1 0 0
反应(mol) 0.5 0.5 0.5 1.5
平衡(mol) 0.5 0.5 0.5 1.5
平衡后气体的物质的量为3mol,平衡前后,气体的质量不变,则混合气体的平均相对分子质量之比=![]() :
:![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(3)根据电子的移动方向可知,右侧电极为负极,通入的气体为甲烷,左侧电极为正极,通入的气体为氧气,甲烷在负极上发生氧化反应生成二氧化碳,电极反应式为CH4+2H2O-8e-==CO2+8H+;用该燃料电池作电源、以石墨作电极电解硫酸铜溶液,一段时间后,若将0.1mol Cu2(OH)2CO3溶解于该溶液,恰好使溶液恢复至起始成分和浓度,说明电解生成的物质为:阴极上生成0.2molCu,0.1mol氢气,阳极上生成0.15mol氧气,转移电子0.15mol×4=0.6mol,则燃料电池中理论上消耗CH4的物质的量为![]() =0.075mol,标准状况下的体积为0.075mol×22.4L/mol =1.68 L,故答案为:O2;CH4+2H2O-8e-==CO2+8H+;1.68 L;
=0.075mol,标准状况下的体积为0.075mol×22.4L/mol =1.68 L,故答案为:O2;CH4+2H2O-8e-==CO2+8H+;1.68 L;
(4)在20mL0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液20mL,反应后的溶液中存在等浓度的NaHCO3和NaCl,浓度均为0.05mol/L,溶液pH=8,说明碳酸氢钠的水解程度大于电离程度,溶液显碱性,溶液中各阴离子的物质的量浓度大小关系为c(Cl-)>c(HCO3-)>c(OH-)>c(CO32-);![]() =
=![]() =
=![]() =
=![]() =200,故答案为:c(Cl-)>c(HCO3-)>c(OH-)>c(CO32-);200。
=200,故答案为:c(Cl-)>c(HCO3-)>c(OH-)>c(CO32-);200。

【题目】三氯化氧磷(POCl3)常用作半导体掺杂剂,实验室制取POCl3并测定产品质量的实验过程如下,据此回答下列问题:
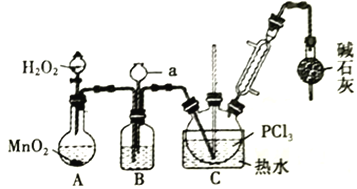
Ⅰ.氧化液态PCl3法制备POCl3:
资料i:有关试剂的性质及实验装置(加热及夹持装置省略)如下:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者均为无色液体,相互溶解;遇水均剧烈水解为两种酸。 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)A 中反应时,MnO2的作用是_________________;仪器a的名称为_________________;
(2)盛有浓硫酸的装置B,其作用除观察O2的流速之外,还有_________________;
(3)实验时应控制反应温度在60~65℃,温度不宜过高的原因是_________________;;如果撤去装有碱石灰的干燥管,则可能降低POCl3的产量,原因是_________________________________(用化学方程式表示,任写一个)。
Ⅱ.沉淀滴定法测定POCl3质量:
资料ii :Ag3PO4为黄色沉淀,易溶于硝酸;
iii:Ag++SCN-=AgSCN↓,且Ksp(AgSCN) <Ksp(AgCl)。
实验步骤如下:
①将三颈烧瓶中的产品POCl3去除杂质,溶于60.00mL蒸馏水中,搅拌使其完全水解,将水解液配成100.00mL溶液;
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.8mol/L AgNO3标准溶液;
③加入少量硝基苯,用力摇动,使沉淀表面覆盖硝基苯;
④加入2~3 滴硫酸铁溶液作指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去10,00mL KSCN溶液。
(4)达到终点时的现象是______________________________;
(5)所得产品POCl3的质量为____________(结果保留两位小数);若取消步骤③,则所得结果将______________(填“ 偏高”、“ 偏低”或“不变”)。

