题目内容
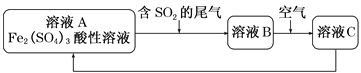
【题目】如图为一些常见物质间的相互转化关系,其中F为金属,高温下能与某些金属氧化物反应,是工业冶炼金属的方法之一. A为无色气体,B为淡黄色固体,C为无色液体,E和J为无色气体单质.
试回答下列问题:
(1)写出B的化学式: , 写出A的电子式;
(2)写出I→K的离子方程式;
(3)写出F与Fe3O4在高温下反应的化学方程式;
(4)已知3g J完全燃烧放出a kJ的热量,请写出表示J的燃烧热的热化学方程式: .
【答案】
(1)Na2O2;![]()
(2)AlO ![]() +CO2+2H2O=Al(OH)3↓+HCO
+CO2+2H2O=Al(OH)3↓+HCO ![]()
(3)8Al+3Fe3O4 ![]() 9Fe+4Al2O3
9Fe+4Al2O3
(4)H2(g)+ ![]() O2(g)=H2O(1)△H=﹣
O2(g)=H2O(1)△H=﹣ ![]() kJ?mol﹣1
kJ?mol﹣1
【解析】解:B为淡黄色固体,B与无色气体A反应生成气体单质E,则B为Na2O2 , A为CO2 , E为O2 , D为Na2CO3 . C为无色液体,与过氧化钠反应生成氧气与G,则C为H2O,G为NaOH.F为常见的金属,高温下能与某些金属氧化物反应,是工业冶炼金属的方法之一,且与NaOH反应生成I与气体单质J,则F为Al,I为NaAlO2 , J为H2 , 则H为Al2O3 , K为Al(OH)3 . (1)由上述分析可知,B为Na2O2 , A为CO2 , 电子式为 ![]() ,所以答案是:Na2O2;
,所以答案是:Na2O2; ![]() ;(2)I→K是过量二氧化碳和NaAlO2的溶液反应生成氢氧化铝与碳酸氢钠,反应离子方程式:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ , 所以答案是:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO
;(2)I→K是过量二氧化碳和NaAlO2的溶液反应生成氢氧化铝与碳酸氢钠,反应离子方程式:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ , 所以答案是:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO ![]() ;(3)Al与Fe3O4在高温下反应的化学方程式反应方程式为:8Al+3Fe3O4
;(3)Al与Fe3O4在高温下反应的化学方程式反应方程式为:8Al+3Fe3O4 ![]() 9Fe+4Al2O3 , 所以答案是:8Al+3Fe3O4
9Fe+4Al2O3 , 所以答案是:8Al+3Fe3O4 ![]() 9Fe+4Al2O3 ;(4)3g H2完全燃烧放出a kJ的热量,则1molH2完全燃烧放出的热量为
9Fe+4Al2O3 ;(4)3g H2完全燃烧放出a kJ的热量,则1molH2完全燃烧放出的热量为 ![]() ×a kJ=
×a kJ= ![]() a kJ,故氢气的燃烧热的热化学方程式:H2(g)+
a kJ,故氢气的燃烧热的热化学方程式:H2(g)+ ![]() O2(g)=H2O(1)△H=﹣
O2(g)=H2O(1)△H=﹣ ![]() kJmol﹣1 ,
kJmol﹣1 ,
所以答案是:H2(g)+ ![]() O2(g)=H2O(1)△H=﹣
O2(g)=H2O(1)△H=﹣ ![]() kJmol﹣1 .
kJmol﹣1 .

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】已知:反应I:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H1反应Ⅱ:2NO(g)+O2(g)2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)5N2(g)+3O2(g)+6H2O(l)△H 3
反应I和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)△H3=(用△H1、△H2的代数式表示);推测反应Ⅲ是反应(填“吸热”或“放热”)
(2)相同条件下,反应I:4NH3(g)+6NO(g)5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示. ①计算0~4分钟在A催化剂作用下,反应速率V(NO)= .
②下列说法不正确的是 .
A.单位时间内H﹣O键与N﹣H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2. ①保持恒温恒容,再充入NO2气体,NO2体积分数(填“变大”、“变小”或“不变”)
②关于平衡体系反应Ⅱ:2NO(g)+O2(g)2NO2(g);△H2说法正确的是 .
A、该反应焓变为负值
B、升高温度,逆反应速率增大,正反应速率减小,反应逆向移动
C、不论增大压强还是减小压强,正方向速率改变的程度更大
D、平衡正向移动,NO的转化率一定增大
E、平衡体系中加入NO2 , 平衡逆向移动,△H2减小
F、混合气体颜色加深说明平衡向右移动,颜色变浅则向左移动.
【题目】某学生用0.1000 molL﹣1KOH液滴定未知浓度的醋酸,其操作分解为如下几步: A.移取20mL待测醋酸注入洁净的锥形瓶,并加入2~3滴指示剂
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH入碱式滴定管至“0”刻度以上1~2cm
E.调节液面至“0”或“0”以下某一刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写);
(2)上述B步骤操作的目的是;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对最终滴定结果的影响是 . (填“增大”、“减小”、或“不变”)
(4)A步骤中,使用的指示剂为 , 判断到达滴定终点的实验现象是:;
(5)如图1为某一次碱式滴定管滴定前液面,其读数值为mL,图2为滴定结束液面,则本次滴定过程共使用了mLKOH标准溶液 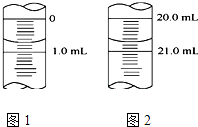
(6)为标定某醋酸溶液的准确浓度,用0.1000molL﹣1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为 . (保留小数点后四位)