题目内容
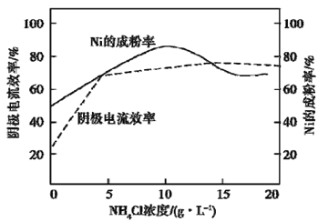
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
请填写下列空白:
(1)写出化学式:A____,B____,C_____,D____,E____。
(2)以上反应中,属于氧化还原反应的有____________(填写编号)。
(3)A→C反应的离子方程式是________。
(4) B→C反应的化学方程式是____________。
(5)E→D反应的化学方程式是_____________。
【答案】Na Na2O2 NaOH Na2CO3 NaHCO3 ①②③④ 2Na+2H2O=2Na++2OH-+H2↑ 2Na2O2+2H2O=4NaOH+O2↑ 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
【解析】
焰色反应为黄色的金属为钠,则A为钠,B为过氧化钠,C为氢氧化钠,D为碳酸钠,E为碳酸氢钠。发生反应的化学方程式为:2Na+O2![]() Na2O2,2Na+2H2O=2NaOH+H2↑,2Na2O2+2H2O=4NaOH+O2↑,2Na2O2+2CO2=2Na2CO3+O2,NaOH+CO2(过量)=NaHCO3,2NaHCO3
Na2O2,2Na+2H2O=2NaOH+H2↑,2Na2O2+2H2O=4NaOH+O2↑,2Na2O2+2CO2=2Na2CO3+O2,NaOH+CO2(过量)=NaHCO3,2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(1)A、B、C、D、E的化学式依次为 Na、Na2O2、NaOH、Na2CO3、NaHCO3。答案为:Na、Na2O2、NaOH、Na2CO3、NaHCO3。
(2)以上反应中,属于氧化还原反应的有①②③④。答案为①②③④
(3)A→C反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑。
答案为:2Na+2H2O=2Na++2OH-+H2↑
(4) B→C反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑。
答案为:2Na2O2+2H2O=4NaOH+O2↑
(5)E→D反应的化学方程式是2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
答案为:2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑

【题目】(14分)某实验小组用0.50 mol·L- 1 NaOH溶液和0.50mol·L- 1 的硫酸溶液进行中和热的测定。
 Ⅰ.配制0.50mol·L- 1 硫酸溶液
Ⅰ.配制0.50mol·L- 1 硫酸溶液
(1)若配制250 mL硫酸溶液,则须用量筒量取密度为1.84 g·cm- 3、质量分数为98%的浓硫酸 mL。
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如右图所示:
(2)仪器A的名称为 ;
(3)装置中碎泡沫塑料的作用是 ;
(4)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol- 1) ;
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的温度差平均值为 ℃;
②近似认为0.50mol·L- 1 NaOH溶液和0.50mol·L- 1 硫酸溶液的密度都是1g·cm- 3 ,中和后生成溶液的比热容c=" 4.18" J·(g·℃)- 1 。则中和热△H= (取小数点后一位)。

③上述实验数值结果与57.3 kJ·mol- 1 有偏差,产生此实验偏差的原因可能是(填字母) 。
A.实验装置保温、隔热效果差 |
B.量取NaOH溶液的体积时仰视读数 |
C.一次性把NaOH溶液倒入盛有硫酸的小烧杯中 |
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 |
【题目】可用如侧示意图象表示的是
反应 | 纵坐标 | 甲 | 乙 |
| |
A | 等质量的钾、钠分别与水反应 | H2的质量 | 钠 | 钾 | |
B | 相同质量的氨气在同一恒容容器发生2NH3 | NH3的转化率 | 500 | 400 | |
C | 体积比为1:3的N2、H2在体积可变的恒压容器中发生2NH3 | NH3的浓度 | 活性高的催化剂 | 活性一般的催化剂 | |
D | 2molSO2与1molO2在同温下发生2SO2+O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
A. A B. B C. C D. D