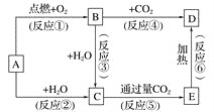
题目内容
【题目】可用如侧示意图象表示的是
反应 | 纵坐标 | 甲 | 乙 |
| |
A | 等质量的钾、钠分别与水反应 | H2的质量 | 钠 | 钾 | |
B | 相同质量的氨气在同一恒容容器发生2NH3 | NH3的转化率 | 500 | 400 | |
C | 体积比为1:3的N2、H2在体积可变的恒压容器中发生2NH3 | NH3的浓度 | 活性高的催化剂 | 活性一般的催化剂 | |
D | 2molSO2与1molO2在同温下发生2SO2+O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
A. A B. B C. C D. D
【答案】A
【解析】
A、钾的活泼性大于钠,等质量的钾、钠分别与水反应,钾反应快、生成氢气少;
B、温度越高反应速率越快,正反应吸热,升高温度平衡正向移动,NH3的转化率增大;
C、催化剂能使反应速率加快,但不能使平衡移动;
D、增大压强反应反应速率加快,增大压强,2SO2+O2![]() 2SO3平衡正向移动,SO3物质的量增大。
2SO3平衡正向移动,SO3物质的量增大。
A、钾的活泼性大于钠,等质量的钾、钠分别与水反应,钾反应快、生成氢气少,所以甲表示钠、乙表示钾,故A正确;
B、温度越高反应速率越快,正反应吸热,升高温度平衡正向移动,NH3的转化率增大,图像是  ,故B错误;
,故B错误;
C、催化剂能使反应速率加快,但不能使平衡移动,图像为 ,故C错误;
,故C错误;
D、增大压强反应反应速率加快,增大压强,2SO2+O2![]() 2SO3平衡正向移动,SO3物质的量增大,图像是
2SO3平衡正向移动,SO3物质的量增大,图像是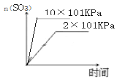 ,故D错误。
,故D错误。

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目