��Ŀ����
����Ŀ������ƽ����ϵmA(g)��nB(g) ![]() pC(g)��qD(g)����H��0�����н����д������
pC(g)��qD(g)����H��0�������������
A. ���¶Ȳ��䣬�������������С��ԭ����һ�룬��ʱA��Ũ��Ϊԭ����2.1������m��n��p��q
B. ��ƽ��ʱ��A��B��ת������ȣ�˵����Ӧ��ʼʱ��A��B�����ʵ���֮��Ϊm��n
C. ��m��n��p��q����������a mol�����ƽ����ϵ���ټ���a mol��B���ﵽ��ƽ��ʱ������������ʵ�������2a
D. ���¶Ȳ���ʱѹǿ����ԭ����2�����ﵽ��ƽ��ʱ�������һ����ԭ����![]() ҪС
ҪС
���𰸡�D
��������
����Ũ�ȡ�ѹǿ���¶ȶԻ�ѧƽ���Ӱ��������
A����������С��ԭ��һ�루����ѹ����˲����A��Ũ��Ϊԭ����2������ƽ��ʱA��Ũ��Ϊԭ����2.1������ƽ�����ơ���ƽ���ƶ�ԭ������m��n ��p��q��A����ȷ��
B�����ʼʱA��B�����ʵ����ֱ�Ϊx��y��ƽ��ʱA��B��ת���ʷֱ�Ϊ����������(x��)��(y��)��m��n����������ʱ��x��y��m��n��B����ȷ��
C�m��n��p��qʱ����Ӧ����������������䡣������a mol�����ƽ����ϵ���ټ���a mol B�������Ƿ�ﵽ��ƽ�⣬���������ʵ���������2a mol��C����ȷ��
D�����С�������ʹ��ƽ��ѹǿ��ԭ����2��������ƽ�����С��ԭ����![]() ����ͨ���뷴Ӧ�ص�����ʹѹǿ���ԭ����2������������Բ��䡣D�����
����ͨ���뷴Ӧ�ص�����ʹѹǿ���ԭ����2������������Բ��䡣D�����
����ѡD��

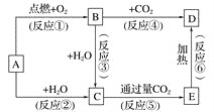
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ijС���о�AgCl���ܽ�ƽ�⣺��10 mL 1mol/L KCl ��Һ�м���1 mL 0.2 mol/LAgNO3��Һ��������Һ����Ϊ2�ݣ���������ʵ�飺
ʵ����� | ʵ����� | ʵ������ |
I | ������һ�ݻ���Һ���ˣ�����Һ�з���Mg��
| i. ��Һ���������ü��������ж�������� ii. ����Mg������������ɫ���ݲ����������ȼ����Һ�г��ְ�ɫ���ǡ� iii. һ��ʱ���ʼ�����غ�ɫ�����Mg������Ҳ��Ϊ�غ�ɫ���������ݵ����ʱ仺���� |
II | ����һ�ݻ���Һ�з����С��ͬ��Mg��
| iv. �غ�ɫ������������Զ���ʵ��I��Mg�������غ�ɫ�������������ii��iii��ͬ�� |
��֪��AgOH���ȶ��������ֽ�ΪAg2O���غ�ɫ���غ�ɫ����Ag��Ϊ��ɫ��AgCl��Ag2O������Ũ��ˮ����Ag(NH3)2��
��1����Һ������ɢϵΪ________��
��2������ii����ɫ���ݲ�����ԭ����_________��д����ѧ����ʽ����
��3������iii�У����²������ݵ������½�����ҪӰ��������________��
��4������ΪMg��������غ�ɫ������һ����Ag��Ag2O����������Ag�����ӷ���ʽΪ____��
��5�������ʵ�����Ag��ȡʵ��I�б����Ϊ�غ�ɫ��Mg�����Թ��У������м��������Լ�a����Ӧ�������������м���Ũ���ᣬ������ɫ���壬��Һ���а�ɫ�����
�� ��ɫ������Ϊ_____���ѧʽ������ɫ���������ԭ����_____��д���ӷ���ʽ����
�� �Լ�aΪ________�������Լ�a��Ŀ����________��
�� ��ʵ����֤���غ�ɫ������һ����Ag��ʵ��������________��
��6����һ�����ʵ����֤��Mg��������غ�ɫ��������Ag2O��ʵ�鷽���ǣ�ȡʵ��I�б����Ϊ�غ�ɫ��Mg��_________��
��7���ۺ�����ʵ�飬��˵������AgCl(s) ![]() Ag+(aq) + Cl��(aq)��֤�ݼ�������________��
Ag+(aq) + Cl��(aq)��֤�ݼ�������________��