题目内容
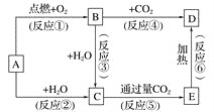
【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如下:

已知:ⅰ分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3—![]() Ag++2SO
Ag++2SO![]()
ⅲ“分铜”时各元素的浸出率如下表所示。

(1)由表中数据可知,Ni的金属性比Cu______。分铜渣中银元素的存在形式为(用化学用语表示)______。“分铜”时,如果反应温度过高,会有明显的放出气体现象,原因是_______。
(2)“分金”时,单质金发生反应的离子方程式为________。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。

“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为_______。调节溶液的pH不能过低,理由为______(用离子方程式表示)。
(4)已知Ksp[Ag2SO4]=1.4×10-5,沉银时为了保证不析出Ag2SO4,应如何控制溶液中SO42—浓度(假定溶液中Ag+浓度为0.1mol/L)。________。
(5)工业上,用镍为阳极,电解0.1 mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:
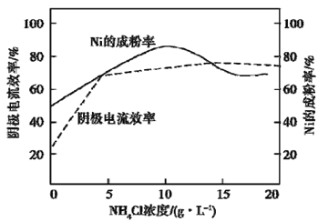
为获得髙纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为_______g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为_______。
【答案】强 Ag、AgCl H2O2分解放出氧气 2Au+ClO3-+7Cl-+6H+=2[AuCl4]- +3H2O 分银液中存在[Ag(SO3)2]3—![]() Ag++2SO32-,加H2SO4至pH=4,SO32-转化为HSO3-,c(SO32-)减小,平衡正向移动,c(Ag+)增大,Ag+与分银液中Cl-反应生成AgCl SO32-+ 2H+ = SO2↑+H2O 溶液中SO42—浓度应低于1.4×10-3mol/L 10 H2
Ag++2SO32-,加H2SO4至pH=4,SO32-转化为HSO3-,c(SO32-)减小,平衡正向移动,c(Ag+)增大,Ag+与分银液中Cl-反应生成AgCl SO32-+ 2H+ = SO2↑+H2O 溶液中SO42—浓度应低于1.4×10-3mol/L 10 H2
【解析】
铜阳极泥中加入硫酸、过氧化氢和氯化钠进行分铜,“分铜”时,单质铜发生的反应是铜在酸性溶液中被过氧化氢氧化生成硫酸铜和水,“分铜”时加入足量的NaCl可以使溶解出的Ag+形成AgCl进入分铜渣;加入盐酸和氯酸钠进行分金,“分金”时,单质金发生的反应是金和加入的氯酸钠和盐酸发生氧化还原反应生成[AuCl4]-,分金液的主要成分为[AuCl4]-;分金渣的主要成分为AgCl,加入亚硫酸钠进行分银,过滤得到的分银液中主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-Ag++2SO32-加入硫酸沉银,促使[Ag(SO3)2]3-Ag++2SO32-平衡正向移动,电离出Ag+,Ag+与分银液中的Cl-反应生成AgCl,以此解答该题。
(1)由表中数据可知,镍的Ni浸出率比铜高,说明镍容易被氧化,因此金属性Ni比Cu强。根据上述分析,“分铜”时加入足量的NaCl可以使溶解出的Ag+形成AgCl进入分铜渣,分铜渣中银元素的存在形式为Ag、AgCl;“分铜”时,如果反应温度过高,双氧水发生分解,会有明显的气体放出现象,故答案为:强;Ag、AgCl;H2O2分解放出氧气;
(2)分金液的主要成分为[AuCl4]-,“分金”时,单质金发生的反应是金和加入的氯酸钠和盐酸发生氧化还原反应生成[AuCl4]-,反应的离子方程式为:2Au+ClO3-+7Cl-+6H+=2[AuCl4]-+3H2O,故答案为:2Au+ClO3-+7Cl-+6H+=2[AuCl4]-+3H2O;
(3)分银液中主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-Ag++2SO32-,H2SO4电离出的H+降低了SO32-的浓度,平衡正向进行,能够析出AgCl 的原因为:H2SO4电离出的H+降低了SO32-的浓度,促使[Ag(SO3)2]3-Ag++2SO32-平衡正向移动,电离出Ag+,Ag+与分银液中的Cl-反应生成AgCl,调节溶液的pH 不能过低理由为:避免产生污染气体SO2,
故答案为:H2SO4电离出的H+降低了SO32-的浓度,促使[Ag(SO3)2]3-Ag++2SO32-平衡正向移动,电离出Ag+,Ag+与分银液中的Cl-反应生成AgCl;避免产生污染气体SO2;
(3)分银液中主要成分为[Ag(SO3)2]3-,由于存在[Ag(SO3)2]3-Ag++2SO32-,H2SO4电离出的H+降低了SO32-的浓度,平衡正向进行,c(Ag+)增大,Ag+与分银液中Cl-反应生成AgCl;如果溶液的pH 过低,硫酸会与亚硫酸根离子反应放出气体SO2,产生污染,反应的离子方程式为SO32-+ 2H+ = SO2↑+H2O,故答案为:分银液中存在[Ag(SO3)2]3—![]() Ag++2SO32-,加H2SO4至pH=4,SO32-
Ag++2SO32-,加H2SO4至pH=4,SO32-
(4)c(SO42—)=![]() =
=![]() =1.4×10-3 mol/L,因此沉银时为了保证不析出Ag2SO4,应如何控制溶液中SO42—浓度低于1.4×10-3mol/L,故答案为:溶液中SO42—浓度应低于1.4×10-3mol/L;
=1.4×10-3 mol/L,因此沉银时为了保证不析出Ag2SO4,应如何控制溶液中SO42—浓度低于1.4×10-3mol/L,故答案为:溶液中SO42—浓度应低于1.4×10-3mol/L;
(5)根据图象可知,NH4Cl的浓度为10gL-1时,镍的成粉率最高,所以NH4Cl的浓度最好控制为10 gL-1,当NH4Cl浓度大于15gL-1时,阴极有气体生成,阴极发生还原反应,阴极生成的气体为氢气,溶液中铵根离子水解溶液呈酸性,阴极电极反应式为:2H++2e-=H2↑或2NH4++2H2O+2e-=2NH3H2O+H2↑,产生气体为氢气,故答案为:10;H2。

【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。