题目内容
【题目】用0.1000mol/L的标准盐酸分别滴定20.00mL的0.1000mol/L氨水和20.00mL的0.1000mol/L氢氧化钠溶液的滴定曲线如图所示,横坐标为滴定百分数(滴定用量/总滴定用量),纵坐标为滴定过程中溶液pH,甲基红是一种酸碱指示剂,变色范围为4.4-6.2,下列有关滴定过程说法正确的是

A. 滴定氨水溶液当滴定分数为50%时,各离子浓度间存在关系:c(NH4+)+c(H+)=c(OH-)
B. 滴定分数为100%时,即为滴定过程中反应恰好完全的时刻
C. 从滴定曲线可以判断,使用甲基橙作为滴定过程中的指示剂准确性更佳
D. 滴定氨水溶液当滴定分数为150%时,所得溶液中离子浓度有大小关系c(Cl-)>c(H+)
【答案】B
【解析】A.溶液中存在的电荷守恒应为c(NH4+)+c(H+)=c(OH-)+c(Cl-),故A错误;B. 滴定分数为100%时,酸与碱的物质的量相等,即为滴定过程中反应恰好完全的时刻,故B正确;C.从滴定曲线看甲基红变色范围更接近于滴定终点,使用甲基橙显示偏晚,故C错误;D.滴定分数为150%时,即加入盐酸30.00ml,此时溶质是NH4Cl和HCl,物质的量之比为2:1,故c(NH4+)>c(H+),故D错误;答案为B。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH2=+172.5kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为_________ 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_________ 。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2 |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为 (填序号)。

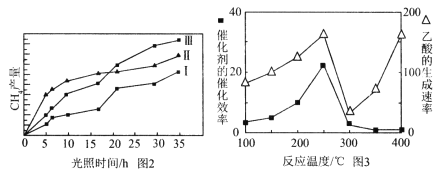
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是__________________。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:________________________。
