题目内容
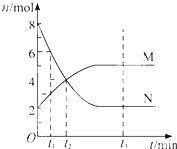
【题目】某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应在__________min时达到平衡状态;
(2)该反应的化学方程式为_________________________________________________。
(3)反应开始至2 min,气体Z的反应速率为______________________________。
(4)若X、Y、Z均为气体,反应达到平衡时压强是开始时的____________倍;
【答案】 2 3X+Y![]() 2Z 0.05 mol/(L·min) 0.9
2Z 0.05 mol/(L·min) 0.9
【解析】由图像可知,反应到2min后各组分的浓度保持不变了,所以该反应为可逆反应并且在2min时达到了化学平衡状态。由于X、Y物质的量减少了,而Z增多了,所以X和Y是反应物,Z是生成物,根据它们的化学计量数之比等于它们的变化量之比=0.3:0.1:0.2=3:1:2,确定各物质的化学计量数分别为3、1、2。
(1)该反应在2 min时达到平衡状态;
(2)该反应的化学方程式为3X+Y![]() 2Z 。
2Z 。
(3)反应开始至2 min,气体Z的反应速率为v=![]() =0.05 mol/(Lmin )。
=0.05 mol/(Lmin )。
(4)若X、Y、Z均为气体,反应达到平衡时压强与开始时压强之比等于气体的物质的量之比=![]() =0.9,所以反应达到平衡时压强是开始时的0.9 倍;
=0.9,所以反应达到平衡时压强是开始时的0.9 倍;

【题目】金属钒及其化合物有着广泛的应用,现有如下回收利用含钒催化剂[含有V2O5、VOSO4(强电解质)及不溶性残渣]的工艺的主要流程:

部分含钒物质在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 | HVO3 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 | 难溶 |
请回答下列问题:
(1)工业上常用铝热反应由V2O5冶炼金属钒,化学方程式为__________。
(2)反应①、②、③、④中,发生氧化还原反应的是__________(填序号),写出反应①的离子方程式____。操作1、操作2用到的玻璃仪器是___________。
(3)反应③的沉淀率(又称沉钒率)是回收钒的关键之一,下图是反应温度与沉钒率的关系图,则控制温度的方法是_____________。

(4)反应④在焙烧过程中随温度的升高发生了两步反应。已知234gNH4VO3固体质量的减少值△W随温度(T)变化的曲线如图。试写出300℃~350℃时反应的化学方程式___________。
(5)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+![]() VO2++H2O+V3+。电池充电时阳极的电极反应式为____________。
VO2++H2O+V3+。电池充电时阳极的电极反应式为____________。