题目内容
Ⅰ:利用水煤气合成二甲醚的三步反应如下:
①2H (g)+CO(g)
(g)+CO(g)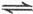 CH
CH OH(g);ΔH=-90.8 kJ·mol
OH(g);ΔH=-90.8 kJ·mol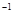
②2CH OH(g)
OH(g)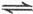 CH
CH OCH
OCH (g)+H
(g)+H O(g);ΔH=-23.5 kJ·mol
O(g);ΔH=-23.5 kJ·mol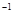
③CO(g)+H O (g)
O (g)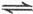 CO
CO (g)+H
(g)+H (g);ΔH=-41.3 kJ·mol
(g);ΔH=-41.3 kJ·mol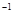
总反应:3H (g)+3CO(g)
(g)+3CO(g)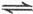 CH
CH OCH
OCH (g)+CO
(g)+CO (g)的ΔH=__________:
(g)的ΔH=__________:
Ⅱ:如图甲、乙是电化学实验装置。
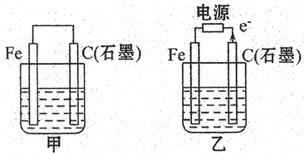
(1)若甲、乙两烧杯中均盛有饱和NaCI溶液。
①甲中石墨棒上的电极反应式__________,电子的移动方向为________;
②乙中总反应的离子方程式为__________,Cl 移向__________电极(填Fe或C);
移向__________电极(填Fe或C);
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl 氧化了生成的I
氧化了生成的I 。若反应中Cl
。若反应中Cl 和I
和I 的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________;
的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________;
(2)若甲、乙两烧杯中均盛有CuSO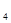 溶液。
溶液。
①甲中铁棒上的电极反应式为:______________________;
②如果起始时乙中盛有200 mL pH=5的CuSO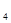 溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。
溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。
①2H
 (g)+CO(g)
(g)+CO(g)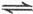 CH
CH OH(g);ΔH=-90.8 kJ·mol
OH(g);ΔH=-90.8 kJ·mol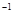
②2CH
 OH(g)
OH(g)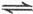 CH
CH OCH
OCH (g)+H
(g)+H O(g);ΔH=-23.5 kJ·mol
O(g);ΔH=-23.5 kJ·mol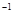
③CO(g)+H
 O (g)
O (g)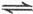 CO
CO (g)+H
(g)+H (g);ΔH=-41.3 kJ·mol
(g);ΔH=-41.3 kJ·mol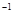
总反应:3H
 (g)+3CO(g)
(g)+3CO(g) CH
CH OCH
OCH (g)+CO
(g)+CO (g)的ΔH=__________:
(g)的ΔH=__________:Ⅱ:如图甲、乙是电化学实验装置。

(1)若甲、乙两烧杯中均盛有饱和NaCI溶液。
①甲中石墨棒上的电极反应式__________,电子的移动方向为________;
②乙中总反应的离子方程式为__________,Cl
 移向__________电极(填Fe或C);
移向__________电极(填Fe或C);③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl
 氧化了生成的I
氧化了生成的I 。若反应中Cl
。若反应中Cl 和I
和I 的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________;
的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________;(2)若甲、乙两烧杯中均盛有CuSO
 溶液。
溶液。①甲中铁棒上的电极反应式为:______________________;
②如果起始时乙中盛有200 mL pH=5的CuSO
 溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。
溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。Ⅰ:-246.4kJ/mol
Ⅱ:(1)①O +2H
+2H O+4e
O+4e =4OH
=4OH ,铁经导线移向石墨。
,铁经导线移向石墨。
②2Cl +2H
+2H O
O 2OH
2OH +H
+H ↑+Cl
↑+Cl ↑, C
↑, C
③5Cl +I
+I +6H
+6H O=10HCl+2HIO
O=10HCl+2HIO
(2)①Fe-2e =Fe
=Fe ②CuO(或CuCO
②CuO(或CuCO ) 0.8(或1.24)
) 0.8(或1.24)
Ⅱ:(1)①O
 +2H
+2H O+4e
O+4e =4OH
=4OH ,铁经导线移向石墨。
,铁经导线移向石墨。②2Cl
 +2H
+2H O
O 2OH
2OH +H
+H ↑+Cl
↑+Cl ↑, C
↑, C③5Cl
 +I
+I +6H
+6H O=10HCl+2HIO
O=10HCl+2HIO
(2)①Fe-2e
 =Fe
=Fe ②CuO(或CuCO
②CuO(或CuCO ) 0.8(或1.24)
) 0.8(或1.24)试题分析:I:根据盖斯定律,观察目标方程式可知,①×2+②+③,即得到3H2(g)+3CO(g)
 CH3OCH3(g) + CO2 (g),故△H=2△H1+△H2+△H3=-246.4kJ·mol -1。
CH3OCH3(g) + CO2 (g),故△H=2△H1+△H2+△H3=-246.4kJ·mol -1。II(1)①根据装置可知甲是原电池,乙是电解池。由于氯化钠溶液显中性,所以发生吸氧腐蚀,石墨是正极,氧气得到电子,方程式为O2+2H2O+4e-=4OH-,电子由负极出正极入,所以电子由铁经导线移向石墨。
②根据乙中电子流向可知,石墨和电源的正极相连,作阳极,溶液中的氯离子放电。铁和电源的负极相连,作阴极,溶液中的氢离子放电。所以总反应式为2Cl-+2H2O
 2OH-+H2↑+Cl2↑,阴离子向阳极移动,所以向石墨极移动。
2OH-+H2↑+Cl2↑,阴离子向阳极移动,所以向石墨极移动。③5mol氯气得到5mol×2=10mol电子,所以根据电子得失守恒可知,单质碘得到10mol电子,因此碘的化合价从0价升高到+5价,所以氧化产物是HIO3。因此方程式为5Cl2+I2+6H2O===10HCl+2HIO3。
(2)①铁是活泼的金属,作负极,所以电极反应式为Fe-2e-=Fe2+。
②乙中阳极是OH-放电,生成氧气。阴极是铜离子放电,生成铜,总反应式为2CuSO4+2H2O
 2H2SO4+2Cu+O2↑。反应中生成氢离子的物质的量是0.2L×0.1mol/L=0.02mol,所以根据方程式可知生成铜是0.1mol,因此要使溶液恢复到电解前的状态,可向溶液中加入0.01mol氧化铜或0.01mol碳酸铜,其质量方便是0.8g、1.24g。
2H2SO4+2Cu+O2↑。反应中生成氢离子的物质的量是0.2L×0.1mol/L=0.02mol,所以根据方程式可知生成铜是0.1mol,因此要使溶液恢复到电解前的状态,可向溶液中加入0.01mol氧化铜或0.01mol碳酸铜,其质量方便是0.8g、1.24g。点评:本题综合性强,在解决原电池电解池的问题上时,一定要根据最基本的知识点进行判断,不容易出错。

练习册系列答案
相关题目
 Al(OH)3(aq)
Al(OH)3(aq) SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为 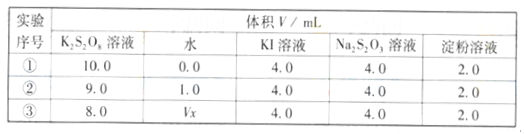
 ΔH=-38.6 kJ·mol-1
ΔH=-38.6 kJ·mol-1