题目内容
(6 分)课本“交流?研讨”栏目有这样一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏1/2mol 氧气中的化学键需要吸收249kJ的能量;形成水分子中1 molH—O键能够释放463kJ 能量。
下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。

① _______________ kJ ②________________ kJ ③_________________kJ
下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。

① _______________ kJ ②________________ kJ ③_________________kJ
(6分,每空2分)①1370 ②1850 ③482
试题分析:①表示破坏反应物中化学键所吸水的能量,所以根据氢气和氧气的键能并结合化学方程式可知应该是436kJ×2+249kJ×2=1370kJ;②表示形成水时放出的能量,因此根据键能可知,应该是463kJ×2×2=1850kJ,所以该反应实际放出的热量是1850kJ-1370kJ=482kJ。
点评:反应热从微观的角度分析,就是断键吸收的能量和形成化学键随放出的能量的差值,据此可以列式进行计算。

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
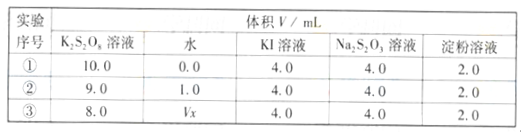
 ΔH=-38.6 kJ·mol-1
ΔH=-38.6 kJ·mol-1 ② (CH3)3COH
② (CH3)3COH