题目内容
已知:(1)Zn(s)+1/2O2(g) = ZnO(s);ΔH =-348.3 kJ/mol;(2)2Ag(s)+1/2O2(g) = Ag2O(s);ΔH =-31.0 kJ/mol,则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的?ΔH等于( )
| A.-317.3 kJ/mol | B.-379.3 kJ/mol | C.-332.8 kJ/mol | D.317.3 kJ/mol |
A
试题分析:根据盖斯定律可知,①-②即得到反应Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s),所以该反应的反应热△H=-348.3 kJ/mol+31.0 kJ/mol=-317.3 kJ/mol,答案选A。
点评:在计算反应热时,常常需要根据盖斯定律并结合数学知识进行。需要注意的是,在扩大化学计量数时,不要忘记了反应热也要同步扩大相应的倍数。

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
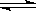 SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为  ΔH=-38.6 kJ·mol-1
ΔH=-38.6 kJ·mol-1 CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。
CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。
 增大的有 。
增大的有 。 E.2α2=α3
E.2α2=α3