题目内容
17.NO是一种剧毒气体,但近年来发现许多生物体组织中存在少量NO,它有扩张血管、免疫、增强记忆的功能,因而成为当前生命科学的研究热点.(1)写出自然界形成NO的化学方程式:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO.
(2)NO在大气层中可发生反应:
NO+O3═NO2+O….①
NO2+O═NO+O2….②
上述反应①中,NO是还原剂,上述反应②中,NO是还原产物.
分析 (1)根据N2和O2在放电的条件下能发生反应;
(2)根据化合价的变化来判断氧化剂、还原产物.
解答 解:(1)因N2和O2在放电的条件下能发生反应:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,故答案为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
(2)因反应①中NO中N的化合价升高,是还原剂;反应②中,NO2中N的化合价降低,是氧化剂,对应的产物是还原产物;
故答案为:还原;还原.
点评 本题主要考查了氮气的性质和氧化还原反应的相关知识,学生通过化合价的变化来判断氧化剂和还原剂以有氧化产物和还原产物的概念,比较容易.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.将0.1mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起( )
| A. | CH3COOH电离程度变大 | B. | 溶液pH减小 | ||
| C. | 溶液的导电能力减弱 | D. | 溶液中c(H+)减小 |
9.下列说法正确的是( )
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 水汽化需要吸收能量,所以水汽化属于吸热反应 | |
| C. | 所有的化合反应都是放热反应 | |
| D. | 1 mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 |
6.有一未知浓度的稀硫酸25mL,先加入25mL5mol/LBaCl2溶液后,改加NaOH溶液,结果用去1.0mol/LNaOH溶液25mL恰好完全中和.则稀硫酸的物质的量浓度为( )
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 1.5mol/L | D. | 2.0mol/L |
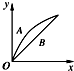
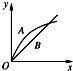
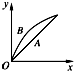

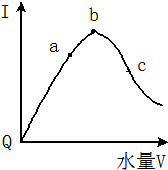 在室温下,冰醋酸加水稀释过程中,溶液导电能力I随加入水量(V表示体积)的变化曲线如图所示,请回答:
在室温下,冰醋酸加水稀释过程中,溶液导电能力I随加入水量(V表示体积)的变化曲线如图所示,请回答: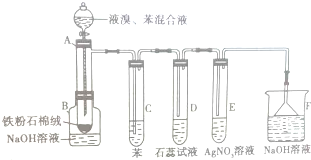 如图为探讨苯和液溴反应改进的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上,填写下列空白:
如图为探讨苯和液溴反应改进的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上,填写下列空白: