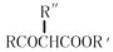题目内容
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。已知:
反应I :4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应 II : 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
写出NO分解生成N2与O2的热化学方程式_____。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I ,测得不同时间的NH3和O2,的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是_____________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3) =6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均速率v( NO)=0.088 mol·L-1·min-1
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:

①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
② 52℃时,4NH3+3O2![]() 2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
③ C点比B点所产生的NO的物质的量少的主要原因________。
(4)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的Cu2+。
已知:25℃时,K1(H2S) =1.3×10-7,K1(2S) =7.1×10-15,Ksp(CuS) =8.5×10-45
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则0.lmol L-1氢
硫酸的pH≈______(取近似整数)。
②某同学通过近似计算发现0.lmol L-1氢硫酸与0.0lmol L-1氢硫酸中的c(S2-)相等,而且等于_____mol·L-1
③已知,某废液接近于中性,若加入适量的氢硫酸,当废液中c(Cu2+) >_____ mol·L-1(计算结果保留两位有效数字),就会产生CuS沉淀。
【答案】 ⑴ 2NO(g)![]() N2(g) +O2(g) △H= -180.8 kJ·mol-1 ⑵AD ⑶①II
N2(g) +O2(g) △H= -180.8 kJ·mol-1 ⑵AD ⑶①II
② ![]() ③该反应为放热反应,当温度升高,平衡向左(逆反应)移动 ⑷① 4 ②7.1×10-15 ③ 1.2×10-30
③该反应为放热反应,当温度升高,平衡向左(逆反应)移动 ⑷① 4 ②7.1×10-15 ③ 1.2×10-30
【解析】(1)已知:反应I :4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1,反应 II : 4NH3(g)+3O2(g)
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1,反应 II : 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1,根据盖斯定律可知( II-I)÷2可得2NO(g) =O2+N2(g) ,△H=[(-1266.6 kJ·mol-1)-(-905.0 kJ·mol-1)]÷2 = △H= -180.8 kJ·mol-1,NO分解生成N2与O2的热化学方程式为2NO(g)
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1,根据盖斯定律可知( II-I)÷2可得2NO(g) =O2+N2(g) ,△H=[(-1266.6 kJ·mol-1)-(-905.0 kJ·mol-1)]÷2 = △H= -180.8 kJ·mol-1,NO分解生成N2与O2的热化学方程式为2NO(g)![]() N2(g) +O2(g) △H= -180.8 kJ·mol-1;
N2(g) +O2(g) △H= -180.8 kJ·mol-1;
(2)A.催化剂的使用,可降低该反应的活化能,加快其反应速率,故A正确;B.当6v正(NH3) =4v逆(H2O)时可说明反应已达平衡,故B错误;C.容器内![]() =1时,无法表明反应达到平衡,故C错误;D.前10分钟内的平均速率v(NH3)=v( NO)=
=1时,无法表明反应达到平衡,故C错误;D.前10分钟内的平均速率v(NH3)=v( NO)=![]() mol·L-1·min-1=0.088 mol·L-1·min-1,故D正确;答案为AD。
mol·L-1·min-1=0.088 mol·L-1·min-1,故D正确;答案为AD。
(3)①由图示可知低温时,容器主要产物为N2,则该催化剂在低温时选择进行反应II;
② 4NH3(g) +5O2(g)![]() 4NO(g) +6H2O
4NO(g) +6H2O
变化物质的量浓度(mol/L) 0.2 0.25 0.2 0.3
4NH3+3O2![]() 2N2+6H2O
2N2+6H2O
变化物质的量浓度(mol/L) 0.4 0.3 0.2 0.6
平衡物质的量浓度(mol/L) 0.4 1.45 0.2 0.9
故520℃时4NH3+3O2![]() 2N2+6H2O的平衡常数K=
2N2+6H2O的平衡常数K=![]() ;
;
③ 已知4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1,正反应是放热反应,当反应达到平衡后,温度升高,平衡向左(逆反应)移动,导致NO的物质的量逐渐减小,即C点比B点所产生的NO的物质的量少;
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1,正反应是放热反应,当反应达到平衡后,温度升高,平衡向左(逆反应)移动,导致NO的物质的量逐渐减小,即C点比B点所产生的NO的物质的量少;
(4)①多元弱酸电离时分步进行,但第一步是主要的,
H2S![]() H+ + HS-
H+ + HS-
起始物质的量浓度(mol L-1) 0.1 0 0
起始物质的量浓度(mol L-1) x x x
起始物质的量浓度(mol L-1) 0.1-x x x
则K1(H2S) =1.3×10-7≈![]() ,解得x≈1.3×10-4mol L-1,0.l mol L-1氢硫酸的pH≈4;
,解得x≈1.3×10-4mol L-1,0.l mol L-1氢硫酸的pH≈4;
②若0.lmol L-1氢硫酸与0.0lmol L-1氢硫酸中的c(S2-)相等,则可近似认为HS-的浓度和H+相等,此时K2(H2S) =[c(H+)c(S2-)]÷c(HS-)=7.1×10-15,c(S2-)=7.1×10-15mol L-1;
③溶液中c(S2-)为7.1×10-15mol·L-1,根据Ksp(CuS) =c(Cu2+) ×c(S2-)=8.5×10-45,可知c(Cu2+) =8.5×10-45÷7.1×10-15=1.2×10-30mol·L-1。

【题目】(1)已知25 ℃时有关弱酸的电离平衡常数:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
① 同温度下,等pH值的a. NaHCO3、b. NaCN、c.Na2CO3溶液的物质的量浓度由大到小的顺序为__________(填序号)。
② 25 ℃时,将20mL 0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20ml0.1mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
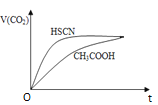
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:________反应结束后所得两溶液中,c(SCN-)________c(CH3COO-)(填“> ”、“< ”或“= ”)
③ 若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是______(填序号)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
(2)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。己知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ mol-1
2NO2(g)![]() N2O4(g) △H=-56.9kJ mol-1
N2O4(g) △H=-56.9kJ mol-1
H2O(g)=H2O(l) △H=-44.0kJ mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式_________
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:请回答下列问题:
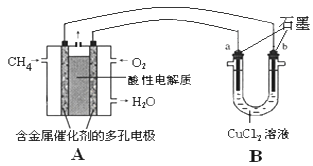
①甲烷燃料电池的负极反应式是____________
②当A中消耗0.15mol氧气时.B 中____极增重_______g。
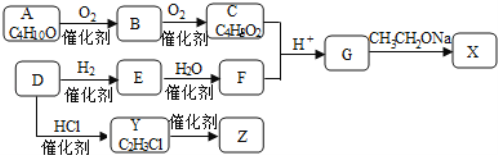
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为88的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的化学方程式为:___________________。
(2)B具有的性质是________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
(3)B在50~60℃时,能与混酸(浓硫酸和浓硝酸的混合溶液)反应,该反应的反应类型是_______________,化学方程式为___________________。
(4)C与D反应生成有香味的物质的化学方程式为: _______________,该反应的反应类型是_______________。
(5)B与液溴及铁反应的化学方程式为:__________, 生成有机物的名称是________。