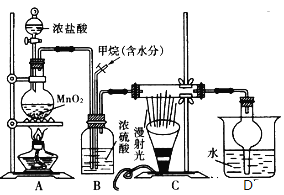
题目内容
【题目】利用醇的消去反应是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示,可能用到的有关数据如下:
相对分子质量 | 密度(g·cm-3) | 沸点/℃ | 溶解性 | |
环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
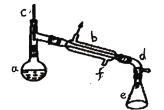
a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。反应粗产物倒入f中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环已烯。回答下列问题:
(1)由环己醇制取环己烯的方程式___________________________________________;
(2)装置b的冷凝水方向是______(填下进上出或上进下出);
(3)加入碎瓷片的作用是______;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是______(填正确答案标号)。
A.立即补加B.冷却后补加C.不需补加D.重新配料
(4)本实验中最容易产生的副产物所含的官能团名称为___________。
(5)在分离提纯中,使用到的仪器f名称是______,分离氯化钙的操作是_______。
(6)合成过程中加入浓硫酸的作用是_______。
【答案】
![]()
![]() +H2O 下进上出 防止暴沸 B 醚键 分液漏斗 过滤 催化剂、脱水剂
+H2O 下进上出 防止暴沸 B 醚键 分液漏斗 过滤 催化剂、脱水剂
【解析】
(1)环己醇在浓硫酸、加热条件下发生消去反应生成环己烯;
(2)冷凝管采用逆向通水,冷凝效果好;
(3)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入;
(4)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应生成二环己醚;
(5)环己烯不溶于水,可通过分液操作分离;氯化钙不溶于环己烯,可通过过滤操作分离;
(6)浓硫酸环己烯的制取过程中起到了催化剂和脱水剂的作用。
(1)在浓硫酸存在条件下,加热环己醇可制取环己烯,反应的化学方程式为:
![]()
![]() +H2O,故答案为:
+H2O,故答案为:
![]()
![]() +H2O;
+H2O;
(2)蒸馏操作中,冷凝管采用逆向通水,即下进上出通水,冷凝效果较好,故答案为:下进上出;
(3)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入,故答案为:防止暴沸;B;
(4)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应,分子间发生脱水反应生成二环己醚,副产物的结构简式为![]() ,含有的官能团为醚键,故答案为:醚键;
,含有的官能团为醚键,故答案为:醚键;
(5)环己烯难溶于水,可通过分液操作分离,使用的仪器为分液漏斗;氯化钙不溶于环己烯,可通过过滤操作分离出氯化钙,故答案为:分液漏斗;过滤;
(6)在反应
![]()
![]() +H2O中,浓硫酸起到了催化剂和脱水剂的作用,故答案为:催化剂、脱水剂。
+H2O中,浓硫酸起到了催化剂和脱水剂的作用,故答案为:催化剂、脱水剂。

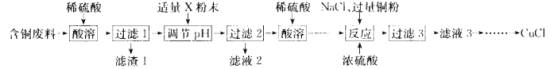
【题目】氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。某同学以含铜废料(主要成分是 CuO、MgO、MnO、SiO2及少量的杂质)为主要原料制备CuCl的主要流程如下:
已知:①CuCl难溶于水和乙醇 ,在潮湿的空气中易被氧化;
②在水溶液中存在平衡 :CuCl(白色)+2Cl-![]() [CuCl3]2-(色无溶液)。
[CuCl3]2-(色无溶液)。
③几种金属氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | 开始沉淀的 pH | 完全沉淀的 pH |
Mg(OH)2 | 8. 4 | 10. 8 |
Cu(OH)2 | 4.2 | 6. 7 |
Mn(OH)2 | 7. 8 | 8. 8 |
问答下列问题:
(1)滤渣1 的主要成分是 _________________(写化学式,下同)。
(2)“调pH”所用粉末状试剂 X 是_____________;pH的调节范闱为____________。
(3)“反应”发生 Cu2+ +Cu+6Cl-=2[CuCl3]2-,表明已完全反应的现象是_______________。
(4)向“滤液3” 加大量的水,过滤可得 CuCl。所得沉淀需再用乙醇洗涤.并在低温下干燥,其原因是___________。
(5)产品纯度的测定,步骤如下:称取mg试样置于锥形瓶中,加入直径 4 ~ 5 mm 玻璃珠适量,并加入 10 mL FeCl3溶液,摇动至样品全部溶解后(CuCl+FeCl3=CuCl2+FeCl2),再加入50 mL,水和2滴邻菲罗啉指示剂,立刻用c mol L-1 的硫酸高铈[Ce(SO4)2]标准溶液滴定(Fe2++Ce4+=Fe3++Ce3+)'滴至终点时共消耗硫酸高铈标准溶液V mL。
①锥形瓶中加入玻璃珠的作用是____________________。
②样品中 CuCl 的质量分数为_____(列出表达式即可 , 用含(c、m、V的代数式表示)。