��Ŀ����
����Ŀ���Ȼ���ͭ(CuCl)�㷺Ӧ����ұ�𡢵�ơ�ҽҩ����ҵ��ijͬѧ�Ժ�ͭ����(��Ҫ�ɷ��� CuO��MgO��MnO��SiO2������������)Ϊ��Ҫԭ���Ʊ�CuCl����Ҫ�������£�
��֪����CuCl������ˮ���Ҵ� ���ڳ�ʪ�Ŀ������ױ�������
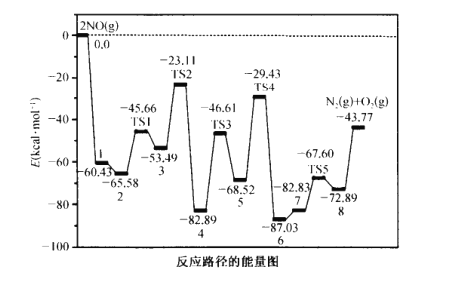
����ˮ��Һ�д���ƽ�� ��CuCl(��ɫ)+2Cl-![]() [CuCl3]2-(ɫ����Һ)��
[CuCl3]2-(ɫ����Һ)��
�����ֽ����������↑ʼ��������ȫ������pH���±���
�������� | ��ʼ������ pH | ��ȫ������ pH |
Mg(OH)2 | 8. 4 | 10. 8 |
Cu(OH)2 | 4.2 | 6. 7 |
Mn(OH)2 | 7. 8 | 8. 8 |
�ʴ��������⣺
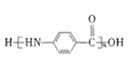
(1)����1 ����Ҫ�ɷ��� _________________(д��ѧʽ����ͬ)��
(2)����pH�����÷�ĩ״�Լ� X ��_____________��pH�ĵ��ڷ���Ϊ____________��
(3)����Ӧ������ Cu2+ +Cu+6Cl-=2[CuCl3]2-����������ȫ��Ӧ��������_______________��
(4)������Һ3�� �Ӵ�����ˮ�����˿ɵ� CuCl�����ó����������Ҵ�ϴ�ӣ����ڵ����¸����ԭ����___________��
(5)��Ʒ���ȵIJⶨ���������£���ȡmg����������ƿ�У�����ֱ�� 4 ~ 5 mm ������������������ 10 mL FeCl3��Һ��ҡ������Ʒȫ���ܽ��(CuCl+FeCl3=CuCl2+FeCl2)���ټ���50 mL��ˮ��2���ڷ�����ָʾ����������c mol L-1 ���������[Ce(SO4)2]����Һ�ζ�(Fe2++Ce4+=Fe3++Ce3+)'�����յ�ʱ����������������ҺV mL��
����ƿ�м��벣�����������____________________��
����Ʒ�� CuCl ����������Ϊ_____(�г�����ʽ���� , �ú�(c��m��V�Ĵ���ʽ��ʾ)��
���𰸡�SiO2 CuO��Cu(OH)2��CuCO3��Cu2(OH)2CO3 6.7��pH��7.8 ��Һ����ɫ��Ϊ��ɫ CuCl�������Ҵ����Ҵ��ӷ������¸���ʱ�ɷ�ֹCuCl���� �����Լ���CuCl���ܽ� ![]() ��100%
��100%
��������
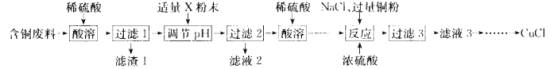
��ͭ����(��Ҫ�ɷ��� CuO��MgO��MnO��SiO2������������)����ϡ�����������ܽⲢ���й���1������SiO2����ϡ���ᷴӦ����õ�������1ΪSiO2����ҺΪ��Ҫ����Cu2+��Mg2+��Mn2+��![]() ��������Һ������Һ�м���X�Լ�������ҺpHֵ�����й���2���ɽ���Һ�е�Cu2+ת��Ϊ��������Һ�з������������Һ2��Ҫ����Mg2+��Mn2+��
��������Һ������Һ�м���X�Լ�������ҺpHֵ�����й���2���ɽ���Һ�е�Cu2+ת��Ϊ��������Һ�з������������Һ2��Ҫ����Mg2+��Mn2+��![]() �����˺�õ��ij���Cu(OH)2�������ϡ��������ܽ�õ�����Cu2+����ɫ��Һ������Һ�м���NaCl��Ũ���ἰ����ͭ�ۣ�������Ӧ��Cu2+ +Cu+6Cl-=2[CuCl3]2-��ת��Ϊ����[CuCl3]2-����ɫ��Һ���ٽ��й���3�õ�����[CuCl3]2-��Һ3������Һ3����һϵ�еIJ�����õ���Ʒ�Ȼ���ͭ(CuCl)���ݴ˷������
�����˺�õ��ij���Cu(OH)2�������ϡ��������ܽ�õ�����Cu2+����ɫ��Һ������Һ�м���NaCl��Ũ���ἰ����ͭ�ۣ�������Ӧ��Cu2+ +Cu+6Cl-=2[CuCl3]2-��ת��Ϊ����[CuCl3]2-����ɫ��Һ���ٽ��й���3�õ�����[CuCl3]2-��Һ3������Һ3����һϵ�еIJ�����õ���Ʒ�Ȼ���ͭ(CuCl)���ݴ˷������
(1)���ݷ���������1 ����Ҫ�ɷ���SiO2��
(2)����pH����Ŀ���ǽ���Һ�е�Cu2+ת��Ϊ������������Һ�з�����������÷�ĩ״�Լ� X ������Һ�е������ӷ�Ӧ�ı���Һ��pHֵ���Ҳ��γ��������������ʳ��������ĩ״�Լ� X������CuO��Cu(OH)2��CuCO3��Cu2(OH)2CO3������һ�֣�����pHֻ����Cu2+��ȫת��Ϊ������Mg2+��Mn2+��Ȼ������Һ�У����ݱ����н����������↑ʼ��������ȫ������pH���ݣ�pH�ĵ��ڷ���Ϊ6.7��pH��7.8��
(3)�����2��õ��ij���Cu(OH)2�м�ϡ��������ܽ�õ�����Cu2+����ɫ��Һ������Ӧ�����跢�� Cu2++Cu+6Cl-=2[CuCl3]2-��������֪��Ϣ��֪[CuCl3]2-��ɫ�����������ȫ��Ӧ����������Һ����ɫ��Ϊ��ɫ��
(4)������Һ3�� �Ӵ�����ˮ�����˿ɵ� CuCl�����ó����������Ҵ�ϴ�ӣ����ڵ����¸����ԭ����CuCl�������Ҵ����Ҵ��ӷ������¸���ʱ�ɷ�ֹCuCl���ʣ�
(5)����ƿ�м��벣����������ǽ����Լ���CuCl���ܽ⣻
�ڸ��ݷ�ӦCuCl+FeCl3=CuCl2+FeCl2��Fe2++Ce4+=Fe3++Ce3+�ɵã�CuCl~ Fe2+~Ce(SO4)2����n(CuCl)=n[Ce(SO4)2]=cmol L-1��V��10-3L=cV��10-3mol��m(CuCl)= cV��10-3mol��99.5g/mol=99.5��cV��10-3g������Ʒ�� CuCl ����������Ϊ![]() ��
��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ�����ô�����ȥ��Ӧ�Ǻϳ�ϩ���ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ����ͼ��ʾ�������õ����й��������£�
��Է������� | �ܶ�(g��cm-3) | �е�/�� | �ܽ��� | |
���Ҵ� | 100 | 0.9618 | 161 | ����ˮ |
����ϩ | 82 | 0.8102 | 83 | ������ˮ |
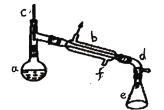
a�м���20g��������2СƬ���Ƭ����ȴ��������������1mLŨ���ᡣb��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90�档��Ӧ�ֲ��ﵹ��f�зֱ�������5%̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ƣ�����ͨ������õ���������ϩ���ش��������⣺
(1)�ɻ�������ȡ����ϩ�ķ���ʽ___________________________________________��
(2)װ��b������ˮ������______(���½��ϳ����Ͻ��³�)��
(3)�������Ƭ��������______���������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ������______(����ȷ�𰸱��)��
A.��������B.��ȴ��C.���貹��D.��������
(4)��ʵ���������ײ����ĸ����������Ĺ���������Ϊ___________��
(5)�ڷ����ᴿ�У�ʹ�õ�������f������______�������Ȼ��ƵIJ�����_______��
(6)�ϳɹ����м���Ũ�����������_______��