题目内容
【题目】石油产品含有多种含硫物质,如H2S、COS等。
(1)一种脱硫工艺为:真空K2CO3-克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数的对数值为1gK=___。
(已知:H2CO3 lgK1=-6.4, lgK2=-10.3;H2S 1gK1=-7,lgK2=-19)
②已知下列热化学方程式:
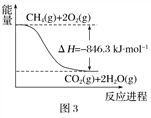
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H1 =-1172kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(l) △H2 =-632kJ·mol-1
克劳斯法回收硫的反应为SO2气体和H2S气体反应生成S(s),则该反应的热化学方程式为___________________。同时,COS发生水解反应: COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H>0,结合以上两个反应,克劳斯法选择反应温度为300℃,温度低有利于____,但温度过低会使硫析出,降低催化剂活性,反应过慢,以及不利于_______________。
CO2(g)+H2S(g) △H>0,结合以上两个反应,克劳斯法选择反应温度为300℃,温度低有利于____,但温度过低会使硫析出,降低催化剂活性,反应过慢,以及不利于_______________。
(2)石灰石料浆作为脱硫剂可有效吸收废气中的SO2,将CO2气体通入石灰石料浆罐对CaCO3脱硫剂进行活化处理可明显提高CaCO3脱硫的效率,活化后的主要脱硫反应之一为:2Ca2++2SO2+O2+3H2O = 2CaSO4·![]() H2O+4H+。
H2O+4H+。
①废气经脱硫后,除水蒸气外,________(填气体化学式)含量明显增多。
②其他条件一定,物料比为1.2时,脱硫反应的速率受Ca2+浓度的影响。图中a点是Ca(OH)2为脱硫剂时的脱硫效率,曲线表示CaCO3活化时间对脱硫效率的影响。

I.CaCO3与SO2反应的速率明显低于Ca(OH)2与SO2反应的速率,其原因是________。
II.a点和b点脱硫效率接近的原因是________________。
【答案】 3.3 2H2S(g) + SO2(g)=3S(s) + 2H2O(l) △H = - 362 kJ·mol-1 H2S 与 SO2反应平衡正向进行 COS 水解 CO2 相同条件下,Ca(OH)2的溶解度大于CaCO3,溶液中产生的Ca2+浓度比CaCO3 产生的Ca2+浓度大 CaCO3 +CO2 + H2O=Ca2+ +2HCO3-,Ca2+浓度增大
【解析】本题考查化学平衡常数的计算、盖斯定律的应用、外界条件对化学平衡和化学反应速率的影响。
(1)①根据平衡常数的表达式和H2CO3、H2S的电离平衡常数计算。
②应用盖斯定律写出SO2气体和H2S气体反应的热化学方程式。H2S与SO2的反应为放热反应,COS的水解反应为吸热反应,温度低有利于H2S与SO2的反应平衡正向移动,温度过低不利于COS的水解。
(2)①石灰石料浆吸收SO2的原理为2CaCO3+2SO2+O2+H2O=2CaSO4·![]() H2O+2CO2;将CO2通入石灰石料浆活化处理,脱硫的原理为CO2+CaCO3+H2O=Ca(HCO3)2,2Ca(HCO3)2+2SO2+O2=2CaSO4·
H2O+2CO2;将CO2通入石灰石料浆活化处理,脱硫的原理为CO2+CaCO3+H2O=Ca(HCO3)2,2Ca(HCO3)2+2SO2+O2=2CaSO4·![]() H2O+4CO2+H2O;废气脱硫后,CO2含量明显增多。
H2O+4CO2+H2O;废气脱硫后,CO2含量明显增多。
②I.相同条件下,Ca(OH)2的溶解度大于CaCO3,Ca(OH)2溶液中产生Ca2+浓度比CaCO3中产生的Ca2+浓度大,浓度越大反应速率越快。
II.用CaCO3脱硫时会产生CO2,CO2与CaCO3、H2O反应生成可溶性Ca(HCO3)2,溶液中Ca2+浓度增大,使a点和b点的脱硫效率接近。
(1)反应K2CO3+H2S=KHS+KHCO3的离子方程式为:CO32-+H2S=HS-+HCO3-,该反应的平衡常数K=![]() =
=![]() =
=![]() ,lgK=lgKa1(H2S)-lgKa2(H2CO3)=-7-(-10.3)=3.3。
,lgK=lgKa1(H2S)-lgKa2(H2CO3)=-7-(-10.3)=3.3。
②对反应编号,
2H2S(g)+3O2(g)=2SO2(g)+2 H2O(l)ΔH1 =-1172kJ·mol-1(I式)
2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH2 =-632kJ·mol-1(II式)
应用盖斯定律,将(II式![]() 3-I式)
3-I式)![]() 2得,2H2S(g)+SO2(g)=3S(s)+2H2O(l)ΔH=[(-632kJ/mol)
2得,2H2S(g)+SO2(g)=3S(s)+2H2O(l)ΔH=[(-632kJ/mol)![]() 3-(-1172kJ/mol)]
3-(-1172kJ/mol)]![]() 2=-362kJ/mol,H2S气体与SO2气体反应生成S(s)的热化学方程式为2H2S(g)+SO2(g)=3S(s)+2H2O(l)ΔH=-362kJ/mol。H2S与SO2的反应为放热反应,COS的水解反应为吸热反应,降低温度,H2S与SO2的反应平衡正向移动,COS的水解反应逆向移动,温度低有利于H2S与SO2的反应平衡正向移动。温度过低不利于COS的水解。
2=-362kJ/mol,H2S气体与SO2气体反应生成S(s)的热化学方程式为2H2S(g)+SO2(g)=3S(s)+2H2O(l)ΔH=-362kJ/mol。H2S与SO2的反应为放热反应,COS的水解反应为吸热反应,降低温度,H2S与SO2的反应平衡正向移动,COS的水解反应逆向移动,温度低有利于H2S与SO2的反应平衡正向移动。温度过低不利于COS的水解。
(2)①石灰石料浆吸收SO2的原理为2CaCO3+2SO2+O2+H2O=2CaSO4·![]() H2O+2CO2;将CO2通入石灰石料浆活化处理,脱硫的原理为CO2+CaCO3+H2O=Ca(HCO3)2,2Ca(HCO3)2+2SO2+O2=2CaSO4·
H2O+2CO2;将CO2通入石灰石料浆活化处理,脱硫的原理为CO2+CaCO3+H2O=Ca(HCO3)2,2Ca(HCO3)2+2SO2+O2=2CaSO4·![]() H2O+4CO2+H2O;废气脱硫后,除水蒸气外,CO2含量明显增多。
H2O+4CO2+H2O;废气脱硫后,除水蒸气外,CO2含量明显增多。
②I.主要的脱硫反应为2Ca2++2SO2+O2+3H2O=2CaSO4·![]() H2O+4H+;相同条件下,Ca(OH)2的溶解度大于CaCO3,Ca(OH)2溶液中产生Ca2+浓度比CaCO3中产生的Ca2+浓度大,Ca2+浓度越大反应速率越快,所以CaCO3与SO2反应的速率明显低于Ca(OH)2与SO2反应的速率。
H2O+4H+;相同条件下,Ca(OH)2的溶解度大于CaCO3,Ca(OH)2溶液中产生Ca2+浓度比CaCO3中产生的Ca2+浓度大,Ca2+浓度越大反应速率越快,所以CaCO3与SO2反应的速率明显低于Ca(OH)2与SO2反应的速率。
II.用CaCO3脱硫时反应为2CaCO3+2SO2+O2+H2O=2CaSO4·![]() H2O+2CO2,脱硫时会产生CO2,CO2与CaCO3、H2O反应生成可溶性Ca(HCO3)2,反应为CaCO3+CO2+H2O=Ca(HCO3)2,溶液中Ca2+浓度增大,使a点和b点的脱硫效率接近。
H2O+2CO2,脱硫时会产生CO2,CO2与CaCO3、H2O反应生成可溶性Ca(HCO3)2,反应为CaCO3+CO2+H2O=Ca(HCO3)2,溶液中Ca2+浓度增大,使a点和b点的脱硫效率接近。

 阅读快车系列答案
阅读快车系列答案【题目】碳和氮是地球上含量丰富的两种元素。其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响。
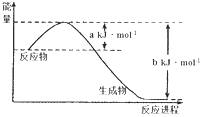
(1)下图是25℃,101kPa时,1molNO2气体和1molCO反应生成CO2和NO过程中能量变化示意图。写出该反应的热化学方程式____________________________________。
(2)在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s)![]() N2(g)+CO2(g),达到平衡时的数据如下:
N2(g)+CO2(g),达到平衡时的数据如下:
温度 | n(C)/mol | n(CO2)/mol |
T1 | 0.3 | |
T2 | 0.6 |
请回答下列问题:
①T1℃时,该反应的平衡常数K=___________。
②T2℃时,下列能判断该反应达到平衡状态的是___________(填序号)。
A.v(CO2)正=2v(NO)逆 B.混合气体的平均相对分子质量不再变化
C.混合气体的密度不再变化 D.N2、CO2的物质的量之比不再变化
③T2℃时,若达平衡后再充入0.4molNO和0.3molCO2,平衡向___________(填“正向”“逆向“或“不”)移动。
④若△H<O,则T1___________T2(填“>”或“<”)。
(3)电解法处理含氮氧化物废气,可回收硝酸。实验室模拟电解法吸收NOx的装置如右图所示:

①若用NO2气体进行模拟电解法吸收实验,写出NO2发生反应的电极反应式________________。
②若有标况下2.24LNO被吸收,通过阳离子交换膜的H+为___________mol。