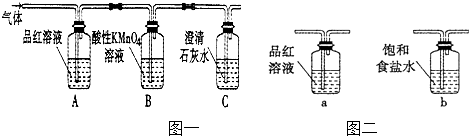
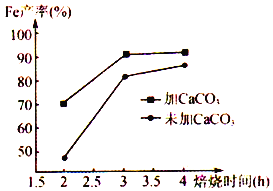
题目内容
【题目】氮及其化合物在生活和生产中应用广泛。
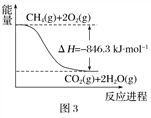
(1)合成氨用的H2可以CH4为原料制得。有关化学反应的能量变化如下图所示。则CH4(g) 与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为________________________________________________。

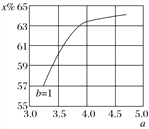
(2)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率(x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。_______。
CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率(x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。_______。
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业生产NaN3主要是在175 ℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式:__________________。
(4)叠氮酸(HN3)是一种一元弱酸,在水溶液中存在:HN3![]() H++N
H++N![]() ,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=____________(用含字母的代数式表示,忽略溶液体积变化)。
,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=____________(用含字母的代数式表示,忽略溶液体积变化)。
(5)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO![]() 可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为_____________________________________________________________。
可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为_____________________________________________________________。
【答案】 CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=161.1 kJ·mol-1  )NaNO3+3NaNH2===NaN3+3NaOH+NH3 ↑
)NaNO3+3NaNH2===NaN3+3NaOH+NH3 ↑ ![]() 2HNO3+2H2O
2HNO3+2H2O![]() 2NH2OH+3O2↑
2NH2OH+3O2↑
【解析】本题以氮及其化合物考查化学反应原理,涉及的考点有盖斯定律、热化学方程式的书写、平衡常数的计算、电极反应式的书写等。(1)图1、图2、图3写出热化学方程式分别为:①CO(g)+![]() O2(g)═CO2(g)△H=-282kJmol-1②H2(g)+
O2(g)═CO2(g)△H=-282kJmol-1②H2(g)+![]() O2(g)═H2O(g)△H=-241.8kJmol-1③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-846.3kJmol-1,由③-(①+②×3)得:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+161.1kJmol-1,故答案为:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+161.1 kJ·mol-1;(2) 当水碳比由1增大到1.5时,结合方程式2NH3(g)+CO2(g)
O2(g)═H2O(g)△H=-241.8kJmol-1③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-846.3kJmol-1,由③-(①+②×3)得:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+161.1kJmol-1,故答案为:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+161.1 kJ·mol-1;(2) 当水碳比由1增大到1.5时,结合方程式2NH3(g)+CO2(g) ![]() CO(NH2)2(l)+H2O(g),平衡向逆向移动,二氧化碳转化率降低,故其在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图为:
CO(NH2)2(l)+H2O(g),平衡向逆向移动,二氧化碳转化率降低,故其在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图为: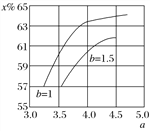 ;(3) 175 ℃时把NaNO3粉末加到熔化的NaNH2中制备NaN3,还生成两种常见的碱性物质为NaOH和NH3,化学反应方程式为:NaNO3+3NaNH2===NaN3+3NaOH+NH3 ↑;(4) 溶液呈中性,c(H+)=10-7,因电离是微弱的,则c(N)=
;(3) 175 ℃时把NaNO3粉末加到熔化的NaNH2中制备NaN3,还生成两种常见的碱性物质为NaOH和NH3,化学反应方程式为:NaNO3+3NaNH2===NaN3+3NaOH+NH3 ↑;(4) 溶液呈中性,c(H+)=10-7,因电离是微弱的,则c(N)=![]() =
=![]() ,c(HN3)= c mol·L-1,Ka=
,c(HN3)= c mol·L-1,Ka=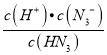 =
=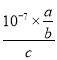 =
=![]() ;(5)由题意可知阴极反应物为NO3—,产物为NH2OH,阳极产物为氧气,故电解反应为2HNO3+2H2O
;(5)由题意可知阴极反应物为NO3—,产物为NH2OH,阳极产物为氧气,故电解反应为2HNO3+2H2O![]() 2NH2OH+3O2↑。
2NH2OH+3O2↑。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案