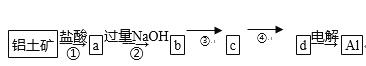
��Ŀ����
����Ŀ������¡�����(2L)���ܱ������г���2 mol SO2��һ������O2��������Ӧ��2SO2(g) + O2(g)![]() 2SO3(g) �� ��H= ��197.74 kJ��mol��1��4min��ﵽƽ�⣬��ʱc(SO2)=0.2mol��L��1����SO2��O2��ת������ȡ�����˵���У�����ȷ����
2SO3(g) �� ��H= ��197.74 kJ��mol��1��4min��ﵽƽ�⣬��ʱc(SO2)=0.2mol��L��1����SO2��O2��ת������ȡ�����˵���У�����ȷ����
A��2minʱ��c(SO2)=0.6mol��L��1
B����O2��ʾ4min�ڵķ�Ӧ����Ϊ0.1mol��(L��min)��1
C�����������г���1mol SO3���ﵽ��ƽ�⣬n(SO2)��n(O2)=2:1
D��4min���������¶ȣ�ƽ�����淽���ƶ���ƽ�ⳣ����С
���𰸡�A
��������
������������������ij�ʼŨ����xmol/L����
2SO2(g) + O2(g)![]() 2SO3(g)
2SO3(g)
��ʼŨ�ȣ�mol/L�� 1 x 0
�仯Ũ�ȣ�mol/L�� 0.8 0.4 0.8
ƽ��Ũ�ȣ�mol/L�� 0.2 x-0.4 0.8
SO2��O2��ת������ȣ���0.4/x=0.8�����x=0.32mol/L
A��0��4min�ڣ���������ķ�Ӧ����=0.8mol/L��4min=0.2mol/��Lmin����ǰ2min��Ӧ���ʴ���0.2mol/��Lmin��������2minʱ��c��SO2����0.6molL-1��A����B����O2��ʾ4 min�ڵķ�Ӧ����Ϊ0.4mol/L��4min=0.1 mol��Lmin��-1��B��ȷ��C�����������г���1 mol SO3�����ɶ�����������������ʵ���֮�Ȳ��䣬�ﵽ��ƽ�⣬���ߵ����ʵ���֮�Ȳ��䣬��n��SO2����n��O2��=2��1��C��ȷ��D����Ӧ�Ƿ��ȵģ�4 min���������¶ȣ�ƽ�����淽���ƶ���K���С��D��ȷ����ѡA��