题目内容
9.下列食物属于碱性食物的是( )| A. | 淀粉 | B. | 肉类 | C. | 青菜 | D. | 油脂 |
分析 食品的酸碱性与其本身的pH值无关(味道是酸的食品不一定是酸性食品),主要是食品经过消化、吸收、代谢后,最后在人体内变成酸性或碱性的物质来界定;
含钾、钠、钙、镁等矿物质较多的食物,在体内的最终的代谢产物常呈碱性,产生碱性物质的称为碱性食品,蔬菜、水果、乳类、大豆和菌类食物等;
含氮、碳、硫、氯、等元素较多的食物,经过消化形成酸根留在体内,产生酸性物质的称为酸性食品,如淀粉类;动物性食物;甜食;油炸食物或奶油类;豆类(如花生等),据此即可解答.
解答 解:A.淀粉在人体内产生酸性物质,属酸性食物,故A错误;
B.肉类富含蛋白质,经过消化形成酸根留在体内,属于酸性食物,故B错误;
C.青菜是含钾、钠、钙、镁等矿物质较多的食物,在人体内产生碱性物质,属于碱性食物,故C正确;
D.油脂属于酸性食物,故D错误.
故选C.
点评 本题主要考查了酸性食物和碱性物质,记住常见的酸性食物和碱性食物是解题的关键,题目难度不大.

练习册系列答案
相关题目
19.下面有关叙述正确的是( )
| A. | 13C与15N有相同的中子数 | |
| B. | 1H2O与2H2O互为同素异形体 | |
| C. | 14C与14N互为同位素 | |
| D. | CH3-CH2OH和CH3-O-CH3互为同分异构体 |
20.下列比较中正确的是( )
①酸性:H2SiO3<H3PO4<HClO4
②碱性:Al(OH)3<Mg(OH)2<Ca(OH)2
③常温时产生气泡的速率:铁与稀硫酸<铁与浓硫酸
④1g氢气完全燃烧放热:生成液态水<生成水蒸气.
①酸性:H2SiO3<H3PO4<HClO4
②碱性:Al(OH)3<Mg(OH)2<Ca(OH)2
③常温时产生气泡的速率:铁与稀硫酸<铁与浓硫酸
④1g氢气完全燃烧放热:生成液态水<生成水蒸气.
| A. | ①②③ | B. | ①②④ | C. | ①② | D. | ③④ |
4.常温下,用0.1mol•L-1的HCl溶液滴定a mL NaOH稀溶液.反应恰好完全时,消耗HCl溶液b mL,此时水溶液中氢氧根离子的浓度c(OH-)是( )
| A. | 0.1b/a mol•L-1 | B. | 1×10-1 mol•L-1 | ||
| C. | 1×10-7 mol•L-1 | D. | 0.1b/(a+b) mol•L-1 |
14.下表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的是( )
| 物质 | 杂质 | 除杂试剂或操作方法 | |
| A. | FeSO4 | CuSO4 | 加入过量铁粉,过滤 |
| B. | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
| C. | NaCl溶液 | I2 | 加酒精,萃取分液 |
| D. | KNO3溶液 | AgNO3 | 加入NaCl溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
1.已知反应:
①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1
②$\frac{1}{2}$N2(g)+O2(g)═NO2(g)△H2
③$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H3
那么在相同温度下反应:4NH3(g)+7O2(g)═4NO2(g)+6H2O(g)的焓变为( )
①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1
②$\frac{1}{2}$N2(g)+O2(g)═NO2(g)△H2
③$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H3
那么在相同温度下反应:4NH3(g)+7O2(g)═4NO2(g)+6H2O(g)的焓变为( )
| A. | 4△H3-6△H1-4△H2 | B. | 6△H1+4△H2-4△H3 | C. | △H1+△H2-△H3 | D. | △H3-△H1-△H2 |
7.下表是元素周期表的一部分,根据所给的10种元素,完成以下各小题.
(1)化学性质最不活泼的元素是?Ne(填元素符号).
(2)镁的原子结构示意图为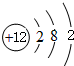 .
.
(3)N与O原子半径较大的是N.
(4)H2SO4与HClO4中,酸性较强的是HClO4.
(5)NaOH与Al(OH)3中,属于两性氢氧化物的是,它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(6)Si是良好的半导体材料,它的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料).
(7)碳元素形成的一种氧化物的化学式是?CO或CO2,该物质中C元素与O元素的质量比为3:4或3:8?.(相对原子质量:C-12 O-16)
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)镁的原子结构示意图为
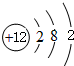 .
.(3)N与O原子半径较大的是N.
(4)H2SO4与HClO4中,酸性较强的是HClO4.
(5)NaOH与Al(OH)3中,属于两性氢氧化物的是,它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(6)Si是良好的半导体材料,它的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料).
(7)碳元素形成的一种氧化物的化学式是?CO或CO2,该物质中C元素与O元素的质量比为3:4或3:8?.(相对原子质量:C-12 O-16)
 ,取代反应;
,取代反应; ,加聚反应.
,加聚反应.