题目内容
1.已知反应:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1
②$\frac{1}{2}$N2(g)+O2(g)═NO2(g)△H2
③$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H3
那么在相同温度下反应:4NH3(g)+7O2(g)═4NO2(g)+6H2O(g)的焓变为( )
| A. | 4△H3-6△H1-4△H2 | B. | 6△H1+4△H2-4△H3 | C. | △H1+△H2-△H3 | D. | △H3-△H1-△H2 |
分析 已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1
②$\frac{1}{2}$N2(g)+O2(g)═NO2(g)△H2
③$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H3
根据盖斯定律,①×6-③×4+②×4可得:4NH3(g)+7O2(g)═4NO2(g)+6H2O(g),反应焓变也进行相应的计算.
解答 解:由①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1
②$\frac{1}{2}$N2(g)+O2(g)═NO2(g)△H2
③$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H3
根据盖斯定律,①×6-③×4+②×4可得:4NH3(g)+7O2(g)═4NO2(g)+6H2O(g),故反应焓变△H=6△H1+4△H2-4△H3,故选B.
点评 本题考查根据盖斯定律进行反应热的计算,难度不大,关键是由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.有下列物质:①C2H6、②C2H4、③C2H2、④H2、⑤ 、⑥
、⑥ 、⑦
、⑦ 、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬
、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬ .能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )
.能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )
 、⑥
、⑥ 、⑦
、⑦ 、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬
、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬ .能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )
.能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )| A. | ⑤⑥⑦ | B. | ④⑨⑩ | C. | ⑪⑫⑬ | D. | ①②③⑧ |
12.氢氰酸(HCN)的下列性质中,不能证明它是弱电解质的是( )
| A. | NaCN的水溶液显碱性 | |
| B. | 1mol/L氢氰酸溶液的pH约为5 | |
| C. | 10mL 1mol/L HCN恰好与10mL 1mol/L NaOH溶液完全反应 | |
| D. | 在相同条件下,HCN溶液的导电性比盐酸溶液弱 |
9.下列食物属于碱性食物的是( )
| A. | 淀粉 | B. | 肉类 | C. | 青菜 | D. | 油脂 |
16.航天飞机用铝粉与高氯酸铵(NH4C1O4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示:2NH4ClO4$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+4H2O+Cl2+2O2↑,下列对此反应的叙述中错误的是( )
| A. | 上述反应中,只有一种元素被氧化 | |
| B. | 反应生成1molN2时,电子转移6mol | |
| C. | 还原产物与氧化产物的物质的量之比为1:3 | |
| D. | 在反应中高氯酸铵既是氧化剂,又是还原剂 |

 ,B的结构式为
,B的结构式为 .
.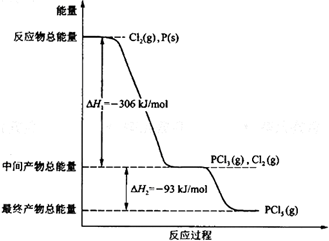 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图示(图中的△H表示生成1mol产物的数据).