题目内容
从以下事实中找出不能应用勒夏特列原理解释的是( )
| A.温度过高对合成氨不利 |
| B.合成氨在高压下进行是有利的 |
| C.合成氨在高温下进行和加入催化剂都能使化学反应速率加快 |
| D.增大N2的浓度可提高平衡混合物中NH3的含量 |
C
勒夏特列原理:如果改变影响平衡的一个条件(如浓度、压强、温度等)平衡就向减弱这种改变的方向移动。
工业合成氨:N2(g)+3H2(g) 2NH3(g)△H<0,升温,平衡逆移;加压,平衡正移;增加N2的浓度,平衡正移,可提高平衡混合物中NH3的含量;
2NH3(g)△H<0,升温,平衡逆移;加压,平衡正移;增加N2的浓度,平衡正移,可提高平衡混合物中NH3的含量;
C.合成氨在高温下进行和加入催化剂都能使化学反应速率加快,但催化剂只改变速率,不改变平衡;使用催化剂,平衡不动,不能应用勒夏特列原理解释;
工业合成氨:N2(g)+3H2(g)
 2NH3(g)△H<0,升温,平衡逆移;加压,平衡正移;增加N2的浓度,平衡正移,可提高平衡混合物中NH3的含量;
2NH3(g)△H<0,升温,平衡逆移;加压,平衡正移;增加N2的浓度,平衡正移,可提高平衡混合物中NH3的含量;C.合成氨在高温下进行和加入催化剂都能使化学反应速率加快,但催化剂只改变速率,不改变平衡;使用催化剂,平衡不动,不能应用勒夏特列原理解释;

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
 Z(g);△H <0
Z(g);△H <0 
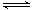 xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下: 2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是 。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是 。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
 CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0 B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表: Fe
Fe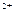
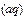 +S
+S