题目内容
(10分) 830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
CO(g)+H2O(g)
 CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
(1)1(2)否、大于因为Qc= 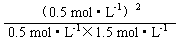 =
=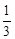 <K,平衡向右移动(3)增大 减小
<K,平衡向右移动(3)增大 减小
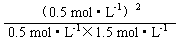 =
=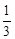 <K,平衡向右移动(3)增大 减小
<K,平衡向右移动(3)增大 减小(1)平衡时c(CO)="0.8" mol·L-1,c(H2O)=1.8mol·L- c(CO2)=c(H2)="1.2" mol·L-由三部曲可以直接求算出平衡常数为1,(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,平衡时c(CO)="0.5" mol·L-1,c(H2O)=1.5mol·L- c(CO2)=c(H2)="0.5" mol·L-计算此条件下的常数为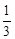 <1不是平衡状态,要向正反应方向移动。(3)若降低温度,正反应方向是吸热方向,平衡向正反应方向移动,该反应的K值将增大,降温速率减小。
<1不是平衡状态,要向正反应方向移动。(3)若降低温度,正反应方向是吸热方向,平衡向正反应方向移动,该反应的K值将增大,降温速率减小。
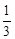 <1不是平衡状态,要向正反应方向移动。(3)若降低温度,正反应方向是吸热方向,平衡向正反应方向移动,该反应的K值将增大,降温速率减小。
<1不是平衡状态,要向正反应方向移动。(3)若降低温度,正反应方向是吸热方向,平衡向正反应方向移动,该反应的K值将增大,降温速率减小。
练习册系列答案
相关题目
 2B(g)+C(g)(正反应为吸热反应),要使B的物质的量增大,而正反应速率降低,可采取的措施是
2B(g)+C(g)(正反应为吸热反应),要使B的物质的量增大,而正反应速率降低,可采取的措施是


 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率为0.1mol·L-1·min-1,以下结论正确的是 ( )
mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率为0.1mol·L-1·min-1,以下结论正确的是 ( )

 2CO(g),K1
2CO(g),K1 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下: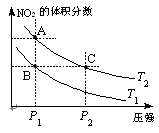
 2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)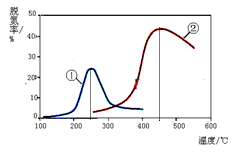
 以下说法正确的是(注:脱氮率即氮氧化物转化率)
以下说法正确的是(注:脱氮率即氮氧化物转化率) B(g)+2C(g),增大压强反应速率加快,A的转化率减小
B(g)+2C(g),增大压强反应速率加快,A的转化率减小 xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是 ( )
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是 ( )